
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Характеристика деяких властивостей ВМС
Ізоелектричний стан.
Розчини високомолекулярних електролітів. Властивості розчинів білків. В'язкість розчинів ВМС, залежність в'язкості від рН середовища.
Здатність ВМС розчинятися в тому або іншому розчиннику залежить від співвідношення полярностей компонентів системи, фазового стану ВМС, гнучкості макромолекул і густини їх упаковки. Так, неполярні полімери, що мають гнучкі молекули, необмежено розчиняються в неполярних розчинниках (наприклад, натуральний каучук в бензині). Полімери з вираженою полярністю і жорсткими ланцюгами не здатні розчинятися в таких розчинниках (наприклад, клітковина), а в полярних розчинниках набухають обмежено. Аморфні полі-мери розчиняються краще, ніж кристалічні.
На розчинність ВМС робить вплив і упаковка молекул в речовині. Наприклад, сполуки з рихлою упаковкою молекул (багато полістиролів) розчи-няються легше, ніж речовини з щільною упаковкою (наприклад, гума). З підвищенням температури розчинність більшості ВМС зростає. Для сильно полярних ВМС і розчинників процес розчинності оборотний.
З молекулярно-кінетичних властивостейрозчинів ВМС найбільш виражені три – дифузія, осмотичний тиск і седіментація. Макромолекули ВМС мають, розміри міцел золей. Вони мають низьку дифузійну здатність. Для визначення коефіцієнта дифузії застосовується метод Ламма. Він заснований на фотографуванні шкали через стовп рідини, де протікає дифузія. Цей метод використовується для визначення молекулярної маси ВМС.
Осмотичний тиск розбавлених розчинів визначається рівнянням Вант-Гоффа
р = (С/т) RТ,
де C – масова концентрація; т – маса 1 молю; R – газова постійна; Т – абсо-лютна температура.
У розчинів ВМС воно вище, ніж за законом Вант-Гоффа. Причина цього – гнучкість молекул полімерів: чим гнучкіша молекула, тим більше відхилення від даного рівняння. Осмотичний тиск розчину ВМС зростає швидше, ніж концентрація. При збільшенні концентрації ВМС збільшується число сегментів, з яких складається його гнучка молекула. Осмотичний тиск розчину сахарози зростає у міру зростання концентрації.
Розчини ВМС седиментаційно стійкі. Це пов'язано з низьким коефіцієнтом дифузії і високим ступенем сольватації, а також з малою густиною розчиненої речовини.
Розчини ВМС відрізняються від ліофобних колоїдних розчинів оптичними властивостями. Так, ланцюгові молекули полімерів не видно під ультрамікроскопом. Розчини ВМС гомогенні, величина їх молекул по довжині наближається до розмірів частинок золю, а по двох параметрах нагадує звичні молекули. Окрім цього, лінійні молекули багатьох ВМС в розчинах неможливо знайти через сильну їхню сольватацію.
Коефіцієнт заломлення розчинів ВМС, як правило, близький до коефіці-єнта заломлення дисперсійного середовища. Розчини ВМС в порівнянні з колоїдними розчинами, розсіюють світло менше. На підставі цього розроблені методи визначення молекулярної маси полімеру по вимірюванню каламутності його розчину при розбавленні. Розчини ВМС вибірково поглинають світло. По інтенсивності поглинання розчинами ультрафіолетових і інфрачервоних спектрів в молекулах полімерів визначають наявність зв'язаних зв'язків і певних атомних груп.
Розчини ВМС – агрегатно стійкі системи. Вони можуть бути розбавленими і концентрованими. Наприклад, концентрація білків в концентрованих розчинах досягає 10-12 %. При введенні в розчини ВМС електролітів (найчастіше нейтральних солей) відбувається їх висолювання. Механізм висолювання відрізняється від механізму коагуляції золю. Коагуляція відбувається при введенні в систему невеликих кількостей електроліту і є необоротнім процесом. При коагуляції відбувається стиснення подвійного електричного шару із зменшенням і навіть зникненням електричного заряду частинок. При висолюванні ВМС заряди витісняються з подвійного електричного поля. При цьому менш розчинна речовина (ВМС) випадає й осад. Зменшення і зникнення розчинності речовини, що висолюється, пов'язане з «відняттям» молекулами або іонами електроліту розчинника, оскільки вони володіють більшою здібністю до сольватації.
Ф. Гофмейстер (1886) встановив ліотропні ряди. Так, у катіонів осаджуюча здатність ВМС зменшується в наступній послідовності: Li+ > Na+ > К+ > Rb+ > Сs+. Аналогічний ряд встановлений і для аніонів: SO42- > Сl- > NO3- > Вг- > I- > CNS-.
Місце розміщення катіона або аніона в такому ряду визначається його здатністю зв'язувати розчинник. Чим більше іон здатний зв'язувати молекули розчинника, тим краще висолюється з розчину полімер. Висолювання часто застосовується в хімії. Його використовують для отримання фарбників з водних розчинів, виділення окремих фракцій білків з сироватки крові та інших біологічних рідин. Висолювання білків доцільно проводити при значеннях рН, близьких до ІЕТ, оскільки збільшення або зменшення сН приводить до підвищення заряду і гідратації білків, їх розчинності.
ВМС можуть осідати з розчинів рідинами, які добре змішуються з розчинниками, але самі не здатні розчиняти ВМС. Їх називають не розчинниками . Так, білок з водного розчину можна виділити у вигляді осаду, додаючи етанол, а каучук з розчину в бензолі, додаючи ацетон. При додаванні не розчинника зростає взаємне тяжіння молекул ВМС, що приводить до витіснення молекул і іонів розчинника з сольватованих частинок і формуванні крупних агрегатів ВМС. Висолювання – оборотний процес, оскільки після видалення з осаду електроліту промиванням або діалізом ВМС знову розчиняється.
При дії електролітів на розчини ВМС типового виділення пластівців і утворення осаду у ряді випадків не відбувається. Формуються рідкі краплі різних розмірів, які злипаються, утворюючи суцільний шар. Виникають дві рідини, що не змішуються, – концентрована (нижній шар, що складається майже з однієї дисперсної фази) і розбавлена (верхній шар). Таке розшарування розчину ВМС називається коацервацією, а нижній шар – коацерватом. Останній одержують, додаючи до розчину альбуміну концентрований розчин Na2SO4. А. І. Опарін вважав, що коацервати виконували велику роль в процесах походження життя на Землі.
Білкові речовини можуть денатурувати. Денатурація (від лат. dе – при-ставка, що позначає видалення, і natura – природа) – необоротні зміни физико-хімічних властивостей білків під впливом тих або інших дій. Денатурація відбувається при нагріванні, дії іонів важких металів, органічних розчинників, кислот, лугів, алкалоїдних реактивів, ультразвука, іонізуючого опромінювання і ін. Вона пов'язана із структурною перебудовою білковоїі молекули. Відбувається різке зменшення гідрофільності білка. Послабляються внутрішньомолекулярні зв'язки молекули, що формують його вторинну, третинну і четвертинну структуру. Відбувається розрив і переміщення водневих зв'язків, розкручуються поліпептидні ланцюги, глобулярна форма молекул переходить у фібрилярну, гідрофобну ділянки молекули, які раніше були в глибині, приходять в зіткнення з водою. При цьому втрачається здібність до набухання, зникають каталітичні (для ферментів) і інші властивості білків, посилюються кольорові реакції на білки. На біофабриках, де виготовляються вакцини, сироватки, антигени і інші біопрепарати, для запобігання денатурації імунних білків їх виділяють при низьких температурах у присутності нейтральних солей. (NH4)2S04, насичених розчинів глюкози, сахарози або гліцерину. Для цих цілей застосовується і ліофільна сушка, тобто висушування заморожених препаратів в умовах глибокого вакууму.
В'язкість розчинів ВМС
В'язкість розчинів ВМС відрізняється від в'язкості золю і істинних розчинів. У низькомолекулярних розчинів і золю існує пропорційна залежність між концентрацією і в'язкістю. У розчинів ВМС із збільшенням концентрації в'язкість непропорційно зростає. Таке зростання відбувається унаслідок збільшення об'єму дисперсної фази розчину ВМС в результаті її гідратації і наявності в системі гнучких молекул. В'язкість розчинів визначається як опір рідини пересуванню одного її шару щодо іншого. Великі набряклі молекули ВМС збільшують силу тертя між шарами.
Розбавлені розчини (концентрація близько 1 %) мають в'язкість, що перевищує в 18-20 разів в'язкість чистого розчинника. В'язкість розчинів ВМС в середньому перевищує в'язкість розчинників на 13-15 порядків. Макромо-лекули в розчині згинаються, утворюють клубки і обертаються в потоці. Це збільшує тертя сегментів макромолекули з молекулою розчинника. Механізм перебігу концентрованих розчинів ВМС наближається до механізму перемі-щення самих полімерів.
Г. Штаудінгер (1881-1965) запропонував формулу визначення в'язкості розчину ВМС з урахуванням того, що в ньому молекули полімеру не взаємодіють між собою (для розбавлених розчинів):
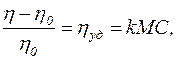 (4
(4
де 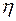 – в'язкість розчину;
– в'язкість розчину; 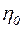 – в'язкість розчинника;
– в'язкість розчинника; 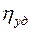 – питома в'язкість; к – константа для кожного полімергомологічного ряду; М – молекулярна маса полімеру; С – концентрація розчину, виражена в «основних молях» на літр («основний моль» – число грам полімеру, чисельно рівне молекулярній масі мономера).
– питома в'язкість; к – константа для кожного полімергомологічного ряду; М – молекулярна маса полімеру; С – концентрація розчину, виражена в «основних молях» на літр («основний моль» – число грам полімеру, чисельно рівне молекулярній масі мономера).
Рівняння (1) використовується і для визначення молекулярної маси полімеру.
В'язкість розчинів ВМС залежить від природи розчинника. У різних розчинниках вона відрізняється на 1000 і більше разів; у розчинниках, які мають хімічну спорідненість з полімером, вона більше, ніж у тих, де полімер погано розчинимо. Тут сольватація макромолекул незначна і вони згортаються в клубок .
Підвищення температури веде до зменшення в'язкості розчинів ВМС. Так, у біополімерів (наприклад білків) мінімальна в'язкість спостерігається при ІЕТ. Максимальна в'язкість виникає при найбільшій іонізації макромолекули. Додавання до розчину ВМС протилежно заряджених іонів підвищує його в'язкість. В'язкість розчинів ВМС зростає із збільшенням тиску, оскільки відбувається орієнтація частинок паралельно потоку і руйнуються глобулярні утворення макромолекул. Підвищення концентрації розчину вибуває утворення асоціатів з макромолекул, а це утрудняє перебіг розчину і підвищує в'язкість. Такі структури руйнуються при підвищенні температури, струшуванні п перемішуванні.
Поліелектроліти
Поліелектроліти – це полімери, до складу молекул яких входять групи, здібні до іонізації в розчині При дисоціації макромолекули виникає велике число іонізації в розчині. При дисоціації макромолекули виникає велике число зарядів, що періодично повторюються. До поліелектролітів відносяться білки, нуклеїнові кислоти, багато полісахаридів. Більшість поліелектролітів містять слабкі кислотні або основні групи (–СООН і –NH2). Їх дисоціація наступає у присутності сильної основи (для полікислот) або сильної кислоти (для поліоснов). При цьому ланцюг полімеру має певний заряд (позитивний або негативний), дисперсійне середовище заряджає протилежно (противоіониі). За природою іонногених груп розрізняють три види поліелектролітов.
1. Полімерні кислоти, молекули яких містять кислотні групи (–СОО-, –OSO32-, –PO43-).
2. Полімерні підстави, що містять основні групи (-NH3, полівінілпірідінову).
3. Поліамфоліти – полімери, що містять одночасно основні і кислотні групи.
Особливої уваги заслуговують «зшиті» поліелектроліти, які одержують шляхом введення в сітчасті полімери легко дисоціюючих груп (наприклад сульфоаміногруп). До них відносяться іонообмінні смоли, полівалентний каркас яких можна розглядати як величезний іон багаторядності, що приймає в свої осередки малі рухомі протиіони.
Поліелектроліти, окрім білків, володіють високою густиною вмісту іоногенних груп. Так, в молекулі поліелектроліта на одну мономірну ланку ланцюга в середньому доводиться одна іоногенная група (у білків одна – СООН або –NH2 група на 6-8 амінокислотних залишків). Властивості молекул поліелектролітів в розчині визначаються електростатичною взаємодією заряджених груп один з одним і низькомолекулярними іонами розчину. Молекули поліелектролітів володіють сильним електростатичним полем. Воно і утримує поблизу молекули поліелектроліту велику кількість противоіонів. Їх число часто складає більше половини числа заряджених груп ланцюга. Якщо в розчин поліелектроліта додати сіль, то число число протиінів практично не змінюється. Коіони (іони того ж знаку, що і іони полімеру) не зв'язуються. Існує правило Мок-Марешаля: при низьких концентраціях поліелектроліта активність противоіонів в розчині у присутності солі дорівнює їх активності у відсутності солі плюс активність однойменно заряджених іонів у відсутності поліелектроліта. Це позначається на осмотичному тиску: осмотичний тиск розчину поліелектроліта і низькомолекулярної солі рівний сумі їх осмотичного тиску при однакових концентраціях.
Багато властивостей поліелектролітів залежать від ступеню їх іонізації. Додавання тих або інших електролітів може змінити ступінь іонізації поліелектроліта. Із збільшенням ступеня дисоціації розміри молекул поліелектролітів можуть збільшуватися в 5 і більше разів.
Із ступенем дисоціації поліелектролітів пов'язана їх розчинність у воді і інших полярних розчинниках. Введення в молекулу полімеру іонних груп збільшує розчинність. Так, полістирол у воді нерозчинний, проте сульфатний полістирол відмінно в ній розчиняється.
Білки як поліелектроліти
Білки – найважливіші біополімери, з діяльністю яких пов'язані всі процеси існування живої матерії на Землі. Білки побудовані із залишків амінокислот, сполучених між собою пептидними зв'язками.. Амінокислоти є амфотерні електроліти, молекули яких містять карбоксильну (–СООН) і амінну (–NH2) групи. До складу різних білків входить в основному 20 амінокислот. Схематично молекулу білка можна зобразити як NH2–R–СООН, де R – залишок молекули білка без функціональних груп. Цей залишок виникає в результаті взаємодії сотень і сотень тисяч амінокислот:
NH2–R'–СООН + НNН–R"–СООН + НNH–R'"–СООН →
NH2–R'СОNH–R"–СОNH–R'"–СООН + 2Н2О.
Молекулярна маса білків коливається від 5700 (інсулін) до 322 000 000 (білок вірусу грипу). У молекулі білка є одна або декілька поліпептідних ланцюгів, що мають вид спіралей, закріплених між собою внутрішньомолеку-лярними водневими зв'язками. Розрізняють чотири рівні структурної організації молекули білка – первинні, вторинні, третинні і чeтвертинні. Є дві основні форми молекули білка – глобулярна (куляста) і фібрилярна (витягнута). У фібрилярних молекул білків довжина макромолекули в сотні і тисячі раз перевищує товщину. Так, довжина молекули проколагена – 300 нм, ширина – десяті частки нанометра, довжина молекул глобулярних білків – 30 нм, ширина – 20-30 нм.
На поверхні молекули білка є велика кількість гідрофільних груп, які створюють гідратну оболонку . Гідрофобні частини молекули в основному розміщуються всередині. При формуванні молекули білка деяка частина молекул води залучається всередину неї і складає інтермицелярну воду. Між молекулами білка циркулює вода, яка називається інтерміцелярна.
Білки є амфолітами. У водному середовищі молекула білка дісоціює на іони, як звичний електроліт. Так, при дисоціації карбоксильних груп молекули білка проявляють властивості кислоти:
NH2 −R−COOH«NH2−R−COO-+ Н+,
а при взаємодії молекул білка з молекулами води виявляються основні властивості.
NH2−R−COOH + HOH « H3+N−R−COOH + HO-.,
Ці властивості виявляються і при взаємодії білка з кислотами і основами. Так, якщо в розчин білка додати сильну кислоту, то карбоксильні групи молекул білка не можуть дисоціювати і макромолекула приймає позитивний заряд:
NH2−R−COOH + HOH «H3+N−R−COOH + HO-,
Якщо в розчин білка додати основу, то білок проявляє властивості кислоти
NН2—R—СООН + NаОН → NH2→NH2—R—СОONa + Н20.
В даний час відомо понад 3000 білків. Вони діляться на прості (протеїни) і складні (протеїди). При гідролізі простих білків в основному утворюються амінокислоти; при гідролізі складних білків утворюються прості білки (а з них амінокислоти) і простетичні групи. По хімічній природі простетичних груп складні білки діляться на нуклеопротеїди фосфопротеїди, хромопротеїди, ліпопротеїди, глікопротеїди і металопротеїди.
По хімічних властивостях білки можуть бути кислими, нейтральними і основними. Кислі властивості білків визначаються переважанням у складі молекул залишків моноамінодикарбонових кислот (аспарагинової і глутамінової), а в складних білках, окрім цього, кислотних функціональних груп (наприклад у фосфопротеїдах — ортофосфорної кислоти). Основні властивості білків-протеїнів залежать від наявності у складі їх молекул великої кількості залишків диаміномонокарбонових амінокислот (наприклад, аргініну, лізину), а в складних білках, окрім цього, простетичних груп, що володіють основними властивостями. Нейтральні білки в молекулах містять однакову кількість основних і кислотних груп.
Молекули кислих білків у воді заряджають негативно, оскільки відщеплювання від молекули кожного іона Н+ повідомляє полімеру один негативний заряд. Молекула основного білка у воді заряджає позитивно. Білки, що володіють у однаковій мірі основними і кислотними властивостями, у водному розчині відщеплюють і приєднують однакову кількість іонів Н+, що обумовлює їх нейтральність.
Процесом відщеплювання і приєднання іонів Н+ молекули білка можна управляти. Так, якщо збільшити сН в розчині кислого білка (наприклад додати кислоти), то рівновага реакції зсунеться вліво і негативний заряд молекули білка зменшиться:
NH2–R–СООН « NН2–R–COO- + H+.
Якщо в розчині основного білка збільшити концентрацію іонів Н+, то зрушення рівноваги реакції відбудеться вправо:
HOOC−R−NH2 + H+ « HOOC−R−NH3+.
Ізоелектрична точка білків
Як вже наголошувалося, заряд молекули білка залежить від реакції середовища і змінюється із зміною цієї реакції. Якщо збільшити або зменшити рН в розчинах, то можна зрівняти кислотні властивості білків з основними або навпаки — основні з кислотними. Наступає ізоелектричний стан (ІЕС), при якому від молекули білка відщеплюється стільки іонів Н+, скільки приєднується. Кількість позитивних зарядів в молекулі білка буде рівна кількості негативних. Водневий показник, при якому наступило ІЕС білка, називається ізоелектричною точкою (ІЕТ). Різні білки характеризуються неоднаковою ІЕТ .
Молекула білка неоднаково заряджає залежно від рН середовища. У середовищах, де концентрація іонів Н+ відповідає ІЕТ, кількість позитивних зарядів в молекулі білка рівна кількості негативних (I). У середовищах, де рН < ІЕТ, іони Н+ приєднуються до іонів карбоксильної групи, молекула білка заряджає позитивно (II). У середовищах, де рН > ІЕТ, молекула білка заряджена негативно(III):
H3+N−R−COOH- (I) H3+N− R−COOH (II) H2N −R−COO- (III)
При ІЕТ частинки білка мають інші властивості, ніж при звичному стані. В умовах ІЕТ білки не мають електрофоретичної рухливості, характеризуються мінімальною стійкістю, розчинністю, гідратацією, в'язкістю, осмотичним тиском, електропровідністю, ступенем набухання, питомим оптичним обертанням і мембранним потенціалом. При ІЕТ відбувається найбільша коагуляція білкових розчинів і вони мають найвищу швидкість желатинування. При ІЕТ деяка частина молекули білка дисоціює, але молекула білка залишається електронейтральною, оскільки при цьому від неї відщеплюється і до неї приєднується однакова кількість іонів Н+ і ОН-.
ІЕТ визначається прямими і непрямими методами. До прямих методів відносяться методи, при яких визначається рН розчину білка, коли рухливість частинок в постійному електричному полі рівна нулю (електрофоретичні методи). Непрямі методи засновані на встановленні рН розчину, коли наступає мінімальна величина в'язкості, набухання або максимальна величина каламутності і осадження білка.
Вивчення ІЕТ багатьох колоїдів організму людини і тварин представляє великий інтерес для діагностики захворювань і оцінки змін, що відбуваються в організмі, органах, тканинах, клітках і субклітинних структурах. Між ІЕТ, стабільністю колоїдів і інтенсивністю обміну речовин і енергії існує певна кореляція
Читайте також:
- I. Загальна характеристика політичної та правової думки античної Греції.
- II. ВИРОБНИЧА ХАРАКТЕРИСТИКА ПРОФЕСІЇ
- II. Морфофункціональна характеристика відділів головного мозку
- Аварії на хімічно-небезпечних об’єктах та характеристика зон хімічного зараження.
- Аверсивную терапію використовують, як правило, при лікуванні алкоголізму, нікотиновій залежності і деяких інших захворювань.
- Автобіографія. Резюме. Характеристика. Рекомендаційний лист
- Автокореляційна характеристика системи
- Акцентуація характеру – перебільшений розвиток певних властивостей характеру на шкоду іншим, в результаті чого погіршуються відносини з оточуючими людьми.
- Амплітудно-частотна характеристика, смуга пропускання і загасання
- Анізотропія властивостей металів.
- Аплікація як вид образотворчої діяльності дошкільнят, його характеристика.
- Архітектура СЕП та характеристика АРМ-1, АРМ-2, АРМ-3
| <== попередня сторінка | | | наступна сторінка ==> |
| Мила та їх властивості | | | Порушення стійкості розчинів ВМС. Висолювання, коацервація |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |