
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Мила та їх властивості
Під милами ми будемо розуміти солі одноосновних відносно високо-молекулярних кислот, яким властива поверхнева активність. Унаслідок цього вони проявляють миючу дію. Однак надалі до мил ми будемо відносити всі сполуки, близькі за будовою і фізико-хімічними власти-востями до звичайних мил. Такі сполуки називають миючими речовинами - детергентами.
Звичайні мила - це солі насичених і деяких ненасичених кислот. Характерні властивості (змочувальна, стабілізуюча і, як наслідок, миюча дія) виявляються тільки в солях тих кислот, в яких кількість вуглецевих атомів коливається в межах 10 22. Солі низькомолекулярних кислот занадто добре розчинні у воді, щоб виявляти такі властивості. Якщо кількість атомів вуглецю перевищує 22, то такі солі у воді практично нерозчинні.
22. Солі низькомолекулярних кислот занадто добре розчинні у воді, щоб виявляти такі властивості. Якщо кількість атомів вуглецю перевищує 22, то такі солі у воді практично нерозчинні.
Миюча дія мил. Для технічних цілей особливе значення мають мила, що містять натрій. Слід виділити натрієві мила пальмітинової (С!5), стеаринової (С17) і ненасиченої олеїнової (С17) кислот. Значно менше застосовуються калієві та амонієві солі, які в звичайних умовах перебувають у рідкому стані. Мила з дво- і тривалентними катіонами використовуються в консистентних змащуваннях. У вуглеводнях вони утворюють колоїдні системи, у воді не розчиняються. Використовуються як стабілізатор
емульсій другого виду.
Чисті мила можуть бути виділені в кристалічному вигляді. Як показали рентгенографічні дослідження, чисті мила мають шарувату будову.
До миючих засобів належать солі високомолекулярних сульфокислот типу СnН 2n+1S03Ме, де Ме - одновалентний катіон.
Як миючі засоби слід відзначити також алкілсульфати - ефіри сірчаної кислоти з вищими спиртами, а також їх солі. Загальна формула алкілсульфатів має вигляд: СnН2n+1 – OS03Ме .
Оскільки сульфокислоти відносяться до класу сильних кислот, то їх солі з полівалентними катіонами, а також самі сульфокислоти у вільному стані досить добре розчиняються у воді. Ці розчини мають мильні властивості. Відзначимо ще одну важливу властивість сульфомил - їх можна використо-увати у твердій і кислій воді.
Катіонактивні мила знайшли широке застосування. У мил цього типу носієм основних властивостей є великий катіон, який адсорбується на поверхні і надає їй значного позитивного заряду. Ця властивість використовується у процесах одержання водовідштовхувальних тканин: їх просочують дисперсіями, які містять гідрофобні сполуки.
Приклад:
- хлористий октадециламоній С18Н37NН2НСІ;
Зрозуміло, що одночасна присутність у розчині катіон- і аніонактивних мил неможлива, тому що вони утворюють слабко іонізовану сіль досить великої молекулярної маси, погано розчинну у воді.
Неіонні мила мають дифільні молекули, кожна з яких містить довгий вуглеводневий ланцюг з декількома неіоногенними групами на кінці (гідроксильні або ефірні групи), що обумовлюють розчинність цих мил.
Високомолекулярні сполуки (ВМС)
До високомолекулярних сполук (ВМС) належать речовини, які складаються з великих молекул (макромолекул) з молекулярною масою не менше 10 000  15 000. Іноді їх молекулярна маса може досягати декількох мільйонів. Отже, розміри молекули ВМС набагато перевищують розміри окремих молекул.
15 000. Іноді їх молекулярна маса може досягати декількох мільйонів. Отже, розміри молекули ВМС набагато перевищують розміри окремих молекул.
Макромолекули дуже чутливі до впливу зовнішніх факторів. Так, наприклад, молекули ВМС легко розпадаються під дією незначної кількості кисню або інших речовин, що викликають деструкцію. Більшість ВМС при підвищенні температури розкладається поступово і не має певної темпера-тури плавлення. У ВМС температура розкладання нижча за температуру кипіння; отже, вони можуть знаходитися тільки в конденсованому стані.
Властивості ВМС залежать не тільки від розміру молекул, але й від їхньої форми. ВМС з ізодіаметричною будовою молекул (гемоглобін, глікоген та ін.), як правило, порошкоподібні речовини, які при розчиненні майже не набухають. Розчини цих сполук задовольняють закону в'язкості Пуазейля, закону дифузії Ейнштейна і закону осмотичного тиску Вант-Гоффа.
ВМС із сильно асиметричними молекулами (желатин, целюлоза, природний і штучний каучуки) при розчиненні сильно набухають, утворю-ють високов'язкі розчини і не задовольняють згаданим вище законам.
Типові структури молекул цих сполук: лінійні і розгалужені молекули ВМС характеризуються типовими для усіх ВМС властивостями: еластич-ністю, здатністю утворювати міцні нитки і плівки, здатністю набухати, утворювати в'язкі розчини.
Експерименти показують, що для ВМС з лінійною структурою молекул характерною є гнучкість. Кожна молекула складається з вуглецевих ланцюжків. Кут між трьома послідовними атомами вуглецю постійний і дорівнює 109°28/. Для його зміни потрібні значні енергетичні витрати.
За таких умов (дані Марка, Гута і Куна) гнучкість зумовлена обертанням макромолекули навколо одинарного валентного зв'язку С , при якому молекула ВМС вигинається і набуває різноманітних просторових форм конфор-мації.
При зниженні температури вільне обертання гальмується, і молекула втрачає гнучкість. При досить низьких температурах вона набуває розтягну-тої форми (рис. 66, а). При підвищенні температури молекула ВМС унаслі-док хаотичного руху скручується в глобулу (сфероїд).
Наявність у молекулах ВМС полярних замісників (замість СН2-груп у кінцевих ділянках - групи -ОН, -СN, -СООН, атоми хлору, фтору та ін.) супроводжується різким зниженням гнучкості ланцюга за рахунок внутрішньомолекулярних взаємодій. Взаємодія функціональних груп окре-мих молекул також приводить до зниження гнучкості.
До природних високомолекулярних речовин належать білки (протеїни), вищі полісахариди (крохмаль і целюлоза), каучук.
До штучних (синтетичних) ВМС відносять у першу чергу синтетичні каучуки (полібутадієн, поліхлоропрен, поліізобутилен і т.ін.), полісілоксани, синтетичні полімери (поліетилен, полівінілхлорид, полівінілацетат та ін.); промислово важливою сполукою є політетрафторетилен (фторопласти).
З неорганічних ВМС слід виділити слюду, алюмосилікати, графіт, алмаз.
Набухання ВМС та елементи теорії їх розчинення ВМС
Розчинення ВМС з лінійними молекулами (іноді з розгалуженими), на відміну від низькомолекулярних сполук, відбувається в декілька етапів. Перша стадія - набухання. Цей процес характерний тільки для ВМС і виражається поглинанням низькомолекулярного розчинника, збільшенням маси, зміною механічних властивостей, однак без зміни однорідності.
Причиною набухання є дифузія молекул розчинника в структуру ВМС. Макромолекули цих сполук упаковані відносно нещільно, в них є порожнечі і щілини, в які й проникають молекули розчинника.
Кількісною характеристикою процесу набухання є ступінь набухання, обумовлений співвідношенням:

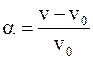 (1)
(1)
де w0 і V0 - наважка та об'єм ВМС до набухання відповідно;
w і V— ті самі параметри після набухання.
Як бачимо, ступінь набухання - це фізична величина, яка чисельно дорівнює масі розчинника, поглиненої одиницею маси ВМС. Визначаючи 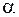 у різні проміжки часу, можна одержати криві
у різні проміжки часу, можна одержати криві 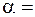 ¦(
¦( ), які ілюструють кінетику процесу набухання.
), які ілюструють кінетику процесу набухання.
 Рис. 1. Характерні кінетичні криві процесу набухання
Рис. 1. Характерні кінетичні криві процесу набухання
|
Типові приклади кінетичних кривих набухання наведені на рис. 2.
Криві 1 і 2 можна описати диференціальним рівнянням:
 (2)
(2)
Розв'язок рівняння цього має вигляд:
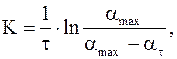 (3)
(3)
де 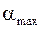 - ступінь граничного набухання (горизонтальна ділянка на кривих 1 і 2 рис. 2);
- ступінь граничного набухання (горизонтальна ділянка на кривих 1 і 2 рис. 2);
 - ступінь набухання до моменту часу
- ступінь набухання до моменту часу  ,
,
К - константа швидкості набухання (залежить від природи ВМС, природи розчинника і температури).
Очевидно, що швидкість набухання визначається параметром da/dt, а здатність ВМС до набухання – параметром 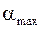 .
.
Зупинимося на характерних ознаках ВМС, які ілюструються кінетичними кривими набухання (рис. 2). Крива 1 відповідає швидкому набуханню, але з малим значенням 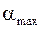 . Крива 2 характеризує повільне набухання ВМС, але з високим значенням
. Крива 2 характеризує повільне набухання ВМС, але з високим значенням 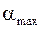 Крива 3 відповідає необмеженому набуханню, коли ВМС цілком розчиняється в розчиннику. У цьому випадку параметр
Крива 3 відповідає необмеженому набуханню, коли ВМС цілком розчиняється в розчиннику. У цьому випадку параметр 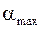 не має фізичного змісту, хоча на кривій і відзначений максимум. Крива 4 ілюструє випадок обмеженого набухання, коли на початкових етапах із ВМС екстрагується значна кількість низькомолекулярних фракцій, що призводить до зниження ступеня граничного набухання.
не має фізичного змісту, хоча на кривій і відзначений максимум. Крива 4 ілюструє випадок обмеженого набухання, коли на початкових етапах із ВМС екстрагується значна кількість низькомолекулярних фракцій, що призводить до зниження ступеня граничного набухання.
Набухання ВМС супроводжується створенням високих тисків, які можна оцінити за рівнянням Позняка:
Р = Ро Ск , (5)
Ск , (5)
де р0 - константа, яка залежить від природи ВМС, розчинника і температури;
С - вміст сухого ВМС у набухаючих драглях;
к – константа, значення якої для більшості ВМС близьке до 3.
Очевидно, що при С -1 р = р0.
Набухання ВМС супроводжується також ефектами контракції (зменшення об'єму системи «ВМС - розчинник» на початкових стадіях) і тепловим ефектом набухання.
Набухання необхідно враховувати в процесах переробки і зберігання зерна. Воно використовується у кондитерському виробництві (приготування різних желе), у хлібопекарській промисловості та інших технологічних процесах харчових виробництв.
Читайте також:
- Аеродинамічні властивості колісної машини
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
- Атрибутивні ознаки і властивості культури
- Білки, властивості, роль в життєдіяльності організмів.
- Біосфера Землі, її характерні властивості
- Будова атомів та хімічний зв’язок між атомами визначають будову сполук, а отже і їх фізичні та хімічні властивості.
- Будова і властивості аналізаторів
- Векторний добуток і його властивості.
- Види і властивості радіоактивних випромінювань
- Визначення добутку на множині цілих невід’ємних чисел, його існування та єдиність. Операція множення та її основні властивості (закони).
- Визначення суми на множині цілих невід’ємних чисел, її існування та єдиність. Операція додавання та її основні властивості (закони).
| <== попередня сторінка | | | наступна сторінка ==> |
| РОЗЧИННИ ВИСОКОМОЛЕКУЛЯРНИХ СПОЛУК. | | | Характеристика деяких властивостей ВМС |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |