
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ТЕМА: ОСНОВИ ТЕРМОДИНАМІКИ
Лекція IX
ПЛАН
1. Внутрiшня енергiя.
2. Теплота i робота.
3. Перший початок термодинамiки.
4. Теплоємнiсть багатоатомних газiв.
5. Адiабатичний процес. Рiвняння Пуассона.
6. Оборотнi та необоротнi процеси. Цикл.
7. Цикл Карно і його коефiцiєнт корисної дiї.
8. Другий початок термодинамiки. Ентропiя.
1. Кожна термодинамічна система характеризується повною енергiєю, в яку входять :
1) кінетична енергія механічного руху системи як цiлого у просторi або її макрочастинок;
2) потенціальна енергія, яка залежить вiд положення системи в зовнiшньому силовому полi;
3) внутрiшня енергiя U, яка залежить вiд внутрiшнього стану системи.
Внутрішня енергія мiстить у собi:
1) кінетичну енергію поступального та обертального руху молекул;
2) потенціальну енергію їх взаємодiї;
3) енергiю коливального руху молекул, електронних оболонок і ядер.
Слiд сказати, що внутрішня енергія є функцiєю параметрiвстану системи (перехiд системи з одного стану в iнший не залежить вiд способу переходу цiєї системи з одного стану в iнший).
 для даної маси.
для даної маси.
В iдеальному газi потенціальна енергія взаємодiї молекул дорiвнює 0. У термодинаміцi не враховується внутрiшньомолекулярна та внутрiшньоядерна енергiя, тому внутрішня енергія iдеального газу однозначно повинна дорiвнювати кінетичній енергії молекул.
Нам відомо, що для однієї молекули  ;
;
а для одного моля  ;
;
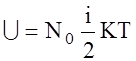 ;
; 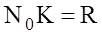 ;
;
 - внутрiшня енергiя одного моля iдеального газу.
- внутрiшня енергiя одного моля iдеального газу.

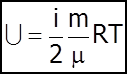 - внутрiшня енергiя iдеального газу.
- внутрiшня енергiя iдеального газу.
2. Змiна стану системи зумовлена передачею енергiї вiд одного тiла системи до iншого, а передача енергiї вiдбувається або у формi виконаної механічної роботи А, або у формi передачi теплоти Q.
Kiлькiсть теплоти Q - це фiзична величина, яка чисельно дорiвнює кiлькостi енергiї, що передається вiд одної системи до iншої внаслiдок теплообмiну.
Вiдомо, що теплота Q i робота А як двi форми передачi енергiї тiсно пов`язанi одна з одною. Одержимо вираз для роботи А при розширеннi газу:
dh
























































 газ
газ 
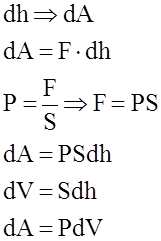
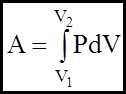 (2)
(2)
Якщо А>0, то газ звершує роботу при розширеннi.
Якщо А<0, то робота звершується над газом, унаслiдок чого вiн стискується.
Розглянемо вираз для роботи для рiзних iзопроцеciв :
1). iзохоричний: V = const; dV = 0;
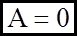
2). iзобаричний:
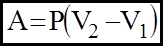
3). iзотермiчний:
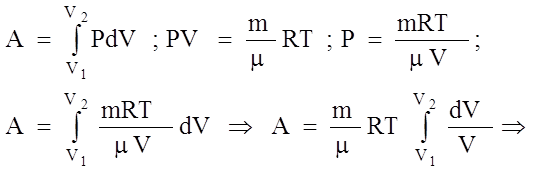

3. Перший початок термодинаміки зумовлює закон збереження та перетворення енергiї стосовно теплових процесiв i формулюється так:
Читайте також:
- A) правові і процесуальні основи судово-медичної експертизи
- R – розрахунковий опір грунту основи, це такий тиск, при якому глибина зон пластичних деформацій (t) рівна 1/4b.
- Активне управління інвестиційним портфелем - теоретичні основи.
- Анатомо-фізіологічні основи статевого розвитку.
- Банківська система: сутність, принципи побудови та функції. особливості побудови банківської системи в Україн
- Банківська система: сутність, принципи побудови та функції. Особливості побудови банківської системи в Україні.
- Банківська система: сутність, принципи побудови та функції. Особливості побудови банківської системи в Україні.
- Біологічні основи мислительної діяльності.
- Біомеханічні основи шинування при пародонтозі.
- Біохімічні основи розвитку витривалості
- Біохімічні основи розвитку силових і швидкісних якостей
- Валютний ринок, основи його функціонування. Основні види валютних операцій
| <== попередня сторінка | | | наступна сторінка ==> |
| ЯВИЩА ПЕРЕНОСУ | | | Це i є формулюванням другого початку термодинаміки, або |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |