
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Хімічно незмінними.
У процесі, самі наприкінці реакції залишаються
Зиваються каталізаторами, які , беручи участь
Каталізом називається змінювання швидкості
Каталіз
Каталіз - надзвичайно важливий розділ хімічної кінетики. Близько 90% усієї продукції хімічних підприємств одержують з використанням каталізаторів.
хімічних реакцій за наявності речовин, які на-
Каталітичні реакції дуже різноманітні, однак до цих пір не існує загальної теорії каталізу. Зазначимо деякі загальні властивості каталітичних реакцій:
1 Дія каталізатора на реакцію не відбивається на її стехіометричному рівнянні. Однак у першому наближенні швидкість реакції прямо пропорційна кількості каталізатора.
2 Каталізатор не зміщує хімічної рівноваги. Якщо реакція оборотна, то каталізатор рівною мірою змінює швидкість прямої та оборотної реакцій.
3 Каталізатор має специфічність дії. Він може змінювати швидкість однієї реакції та не впливати на швидкість іншої.
4 Деякі речовини (не каталізатори) посилюють дію каталізатора, інші - послаблюють. Такі речовини називаються промоторами та ядрами.
Каталіз буває позитивний та негативний. Негативний каталіз - це зменшення швидкості реакції. Якщо немає спеціального застереження, то позитивний каталіз називають просто каталізом.
За наявності каталізатора реакція прискорюється, тобто збільшується константа швидкості реакції ( див. лекцію № 10):
k = Z × e-Ea/RT× eSa/R.
Таким чином, каталізатор збільшує швидкість реакції за рахунок зменшення енергії активації Еа або збільшення ентропії активації Sa (табл. 12.1 і 12.2; рис. 12.7).
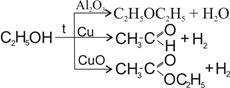
З табл. 12.1 бачимо, що різні каталізатори по-різному знижують енергію активації. Це пов’язано з тим, що кожен каталізатор проводить реакцію своїм шляхом. Іноді цей шлях може привести до інших продуктів:
 .
.
Дані табл. 12.2 підтверджують висновки про те, що, крім енергії активації, в каталітичних реакціях змінюється і ентропія активації. Інакше ніж збільшенням Sa в реакції на срібному каталізаторі неможна пояснити збільшення швидкості розкладання мурашиної кислоти.
Таблиця 12.1 - Енергії активації деяких реакцій
| Реакція | Еа, кДж/моль | Каталізатор | |
| без каталізат. | з каталізат. | ||
2SO2+O2  2SO3
2H2O2 2SO3
2H2O2  2H2O+O2
2NH3 2H2O+O2
2NH3  2H2+N2 2H2+N2
| Pt I2 Каталаза W |
Таблиця 12.2 - Результати вивчення реакції
| Каталізатор | Еа, кДж/моль | Віднос. число активних молекул | Приско- рення реакції |
| Скло Золото Срібло | 102,5 98,3 129,7 | 2,5 0,003 |

Рисунок 12.7 - Вплив каталізатора на енергію активації
Розрізняють гомогенний та гетерогенний каталіз. При гомогенному каталізі реагуючі речовини та каталізатор розміщуються в одній фазі. Як приклад можна привести реакцію окислення діоксиду сірки киснем за наявності каталізатора NO2. Механізм реакції: без каталізатора
SO2 + 1/2O2  SO3,
SO3,
з каталізатором
SO2 + NO2  SO3 + NO,
SO3 + NO,
NO + 1/2O2  NO2.
NO2.
Гомогенний каталіз у розчинах часто спостерігається під дією іонів Н+ і ОН-.
При гетерогенному каталізі реагуючі речовини і каталізатор перебувають у різних фазах. Механізм гетерогенного каталізу у принципі не відрізняється від механізму гомогенного. Атоми або групи атомів утворюють на поверхні твердого каталізатора нестійкі проміжні з’єднання. Завдяки цьому знижується енергія активації і реакція прискорюється у тому або іншому термодинамічно можливому напрямку. Однак механізм процесу при гетерогенному каталізі складніший. Гетерогенно-каталітичний процес проходить через низку стадій:
1) дифузію вихідних речовин з об’єму до зовнішньої поверхні каталізатора;
2) дифузію вихідних речовин у порах зерна каталізатора;
3) адсорбцію вихідних речовин на поверхні каталізатора;
4) власне хімічну реакцію;
5) десорбцію продуктів із поверхні каталізатора;
6) дифузію продуктів від внутрішньої поверхні зерна каталізатора до поверхні пор;
7) дифузію продуктів із зовнішньої поверхні зерна в об’єм.
Будь–яка з цих стадій може контролювати процес. Таким чином, кінетичні закономірності гетерогенно-каталітичного процесу можуть описуватися як законами власне хімічної кінетики, так і законами дифузії і адсорбції. Тому однозначний опис таких процесів неможливий.
Важливу роль при гетерогенному каталізі відіграє поверхня каталізатора. Її намагаються зробити як можна більшою, щоб підвищити швидкість адсорбційних процесів та сумарну швидкість всього процесу. Часто каталізатор напилюють дуже тонким шаром на поверхню речовин, які мають пористу структуру (цеоліти, азбест, силікагель). Сумарна поверхня каталізатора у цих випадках може досягати декількох десятків тисяч м2 на один грам речовини.
Висновки
Розглянуто загальна схема гетерогенної реакції, позначені основні етапи такої реакції. Встановлено способи доставки речовини до поверхні розділу фаз. Дано уявлення про дифузію, розглянуто закони Фіка. Розглянуто елементи кінетики гетерогенних реакцій при стаціонарної і нестаціонарної лінійної дифузії. Розглянуто кінетика топохімічних реакцій. Дано уявлення про каталітични реакції.
Читайте також:
- L2.T4/1.Переміщення твердих речовин по території хімічного підприємства.
- Аварії на хімічно небезпечних об’єктах.
- Аварії на хімічно-небезпечних об’єктах та характеристика зон хімічного зараження.
- Аварійне та довгострокове прогнозування хімічної обстановки
- Біохімічного складу жовчі (дисхолією).
- Вимірювання хімічного складу і концентрації рідини
- Вимірювання хімічного складу рідин
- Висування зведеної команди радіаційного та хімічного захисту об’єкта в осередок ураження
- Вогнище хімічного ураження
- Вплив хімічного складу і швидкості охолодження на структуру і властивості чавуну.
- Джерела живлення установок електрохімічної обробки
- Завдання, види і організація біохімічного контролю
| <== попередня сторінка | | | наступна сторінка ==> |
| Уявлення про топохімічні реакції | | | СТИСЛИЙ конспект лекцІй |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |