
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
СТИСЛИЙ конспект лекцІй
Гетерогенними називаються реакції, в яких реагуючі речовини перебувають у різних фазах, тобто сама реакція проходить на межі розподілу фаз.
Прикладом гетерогенної реакції є реакція розчинення речовини А у речовині В :
А(тв) + В(p) АВ (р-р).
АВ (р-р).
Ця реакція проходить на межі поділу фаз А (тв) - розчин.
У загальному випадку гетерогенна реакція - це послідовність п’яти стадій (см. рис.), кожна з яких має свої особливості:
I - доставка речовини з глибини фази на поверхню поділу;
ІІ - адсорбція вихідних речовин на поверхні поділу;
ІІІ - власне хімічна реакція на поверхні поділу;
ІV - десорбція продуктів реакції з поверхні поділу;
V - відведення продуктів реакції із зони реакції углиб фази.
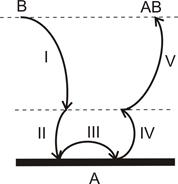
Схема гетерогенної реакції
Транспорт реагуючих речовин може здійснюватися конвекцією або дифузією. Конвекцією називають переміщення всього середовища в цілому. Конвекція розчину на границі з твердою поверхнею може відбуватися внаслідок переміщення твердого тіла або, частіше всього, через переміщення розчину.
Дифузією називається переміщення молекул речовини у нерухомому середовищіпід дією градієнта концентрацій.
Розрізняють дифузію лінійну та просторову, нескінченну та обмежену, стаціонарну та нестаціонарну. Лінійнадифузія відбувається в одному напрямку, просторова - у різних напрямках. Дифузія називається нескінченною,якщо фронт дифузії у процесі гетерогенної реакції не встигає досягнути границі системи; дифузія є обмеженою, якщо фронт досягає границі системи. Під фронтом дифузії розуміють границю всередині розчину, де ще не помітні зміни концентрації, які спричинені процесом дифузії. При стаціонарнійдифузії концентрація речовини в будь-якій заданій точці простору не змінюється з часом; при нестаціонарній -змінюється.
Гетерогенні процеси, як правило, здійснюються у перемішуваних розчинах, тобто доставка речовини до поверхні розподілу здійснюється шляхом конвекції. Однак, згідно з законами гідродинаміки, потік рідини поблизу поверхні твердого тіла уповільнюється, причому шар рідини молекулярних розмірів, безпосередньо прилеглий до поверхні, міцно утримується на ній. Це так званий дифузійний шар товщиною d, крізь який доставлення речовини до поверхні здійснюється тільки за рахунок дифузії. Всередині шару конвекція відсутня. Концентрація речовини у дифузійному шарі на границі з розчином дорівнює концентрації c0 в об’ємі розчину, а всередині дифузійного шару концентрація речовини зменшується до величини cs (рис. 12.2). Товщина дифузійного шару не є константою, а залежить від багатьох величин: щільності, в’язкості розчину, швидкості розчину, швидкості перемішування розчину.
Нехай швидкість стаціонарної дифузії і швидкість реакції на по верхні однакові. Нехай реакція на поверхні є реакцією першого порядку. Тоді для швидкості реакції W маємо
W = kcs 
де k - константа швидкості реакції першого порядку, b - константа швидкості дифузії.
Більшість твердофазних реакцій відносять до класу топохімічних. Топохімічною реакцією називається гетерогенна реакція, в якій бере участь хоча б одна тверда речовина і отримується хоча б один твердий продукт. Прикладами топохімічних реакцій є відновлення диоксиду германію воднем при отриманні напівпровідникового германію
GeO2(т) + 2Н2О(г) --> Ge(т) + 2Н2О(г),
термічне розкладання карбонату кальцію
СаСО3(т) --> СаО(т) + СО2(г).
Топохімічні реакції характеризуються специфічними кінетичними закономірностями. На початку топохімічної реакції швидкість її невелика (індукційний період), потім вона зростає, проходить через максимум та знижується практично до нуля. Ступінь перетворення при цьому звичайно змінюється за S - подібною кривою. Такий характер кінетичних закономірностей можна пояснити таким чином. У міру того як утворюються зародки фази твердого продукту реакції, з’являється реакційна поверхня поділу фаз, яка зростає у часі як внаслідок зростання зародків, що є, так і внаслідок утворення нових зародків.
Відповідно до цього швидкість реакції на початку процесу мала, а потім зростає. З розвитком поверхні поділу фаз зростаючі зародки продукту починають зливатися. Внаслідок відсутності вільної поверхні утворення нових зародків практично не відбувається. Тому площа реакційної поверхні поділу твердих фаз і відповідно швидкість реакції проходять через максимум. У подальшому злиття зародків приводить до зменшення реакційної поверхні та утворення суцільного шару твердого продукту, границя якого поступово просувається в глибину зерна вихідної твердої речовини. При цьому швидкість реакції поступово спадає до нуля.
Читайте також:
- Види лекцій
- Викладення лекційного матеріалу
- ГИСТОЛОГИЯ. КОНСПЕКТ ЛЕКЦИЙ.
- Електронний конспект лекцій
- Завдання лекційних занять
- І. ПРОСЛУХОВУВАННЯ ТА КОНСПЕКТУВАННЯ ЛЕКЦІЙ
- ІІ. МАТЕРІАЛИ ДО КУРСУ ЛЕКЦІЙ
- ІІI. Тематика лекцій
- ІІІ. ПЛАН ПРОВЕДЕННЯ ЛЕКЦІЙНОГО ЗАНЯТТЯ
- Індивідуальний метод обліку кількості знесених яєць проводять у селекційних стадах, застосовують для цього контрольні гнізда, або утримання в індивідуальних клітках.
- Коновалова М.Д.Экспериментальная психология: конспект лекций. - Высшее образование. – 2006.
- КОНСПЕКТ
| <== попередня сторінка | | | наступна сторінка ==> |
| Хімічно незмінними. | | | Історія становлення та розвитку правового регулювання господарської сфери суспільного життя |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |