
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Уявлення про топохімічні реакції
Кінетика реакцій за участю твердих речовин у даний час є важливою проблемою хімічної кінетики. Це пов’язано з тим, що такі реакції покладено в основу численних процесів хімічної промисловості, металургії, технології отримання матеріалів електронної та напівпровідникової техніки.
Більшість твердофазних реакцій відносять до класу топохімічних. Топохімічною реакцією називається гетерогенна реакція, в якій бере участь хоча б одна тверда речовина і отримується хоча б один твердий продукт. Прикладами топохімічних реакцій є відновлення диоксиду германію воднем при отриманні напівпровідникового германію
GeO2(т) + 2Н2О(г) --> Ge(т) + 2Н2О(г),
термічне розкладання карбонату кальцію
СаСО3(т) --> СаО(т) + СО2(г)
та багато інших реакцій. Розглянемо докладніше першу реакцію.
При взаємодії твердого GeO2 та газоподібного водню (реакція проходить при Т ~ 6000С) утворюється металічний германій. Але утворюється він не за всім об’ємом реагенту, а у вигляді окремих острівків, що називаються зародками або ядрами (рис. 12.4). Центри цих зародків розміщуються на поверхні вихідного твердого тіла у місцях дефектів. Зародки проростають в глибину кристала, спочатку незалежно один від одного, а потім – зливаючись та утворюючи загальний реакційний фронт.
Топохімічна реакція локалізована в зоні на межі розподілу між твердим GeO2 і твердим Ge. Швидкість топохімічної реакції визначається як кількістю зародків германію, так і швидкістю їх зростання, тобто сумарною довжиною реакційної зони у всьому зразку у кожний момент часу.

Рисунок 12.4 - Устворення зони в топохімічній реакції
Про швидкість проходження топохімічної реакції роблять висновок із змінення ступеня перетворення a вихідної речовини:
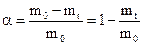 , (12.18)
, (12.18)
где m0 и mt - початкова маса вихідної речовини і її маса через час t після початку реакції. Швидкість топохімічної реакції
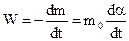 . (12.19)
. (12.19)
Топохімічні реакції характеризуються специфічними кінетичними закономірностями. На початку топохімічної реакції швидкість її невелика (індукційний період), потім вона зростає, проходить через максимум та знижується практично до нуля. Ступінь перетворення при цьому звичайно змінюється за S - подібною кривою (рис. 12.5). Такий характер кінетичних закономірностей можна пояснити таким чином. У міру того як утворюються зародки фази твердого продукту реакції, з’являється реакційна поверхня поділу фаз, яка зростає у часі як внаслідок зростання зародків, що є, так і внаслідок утворення нових зародків.
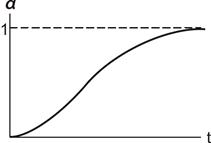
Рисунок 12.5 - Залежність a - t
Відповідно до цього швидкість реакції на початку процесу мала, а потім зростає. З розвитком поверхні поділу фаз зростаючі зародки продукту починають зливатися. Внаслідок відсутності вільної поверхні утворення нових зародків практично не відбувається. Тому площа реакційної поверхні поділу твердих фаз і відповідно швидкість реакції проходять через максимум. У подальшому злиття зародків приводить до зменшення реакційної поверхні та утворення суцільного шару твердого продукту, границя якого поступово просувається в глибину зерна вихідної твердої речовини. При цьому швидкість реакції поступово спадає до нуля.
Математичний опис топохімічних реакцій у загальному вигляді приводить до громіздких результатів із великою кількістю параметрів. Опис кінетики реакції, в якій зародки утворюються тільки на поверхні, значно спрощується у деяких граничних випадках.
1 Зародки утворюються повільно, так, що кожне зерно реагенту встигає повністю перетворитися в продукт, перш ніж на його поверхні з'явиться другий зародок. У цьому випадку
a = 1 - exp (-kt), (12.20)
де k - константа швидкості зародкоутворення.
2 Зародки виникають відразу на всій поверхні й у великій кількості. Поверхня швидко покривається шаром продукту, і реакція розповсюджується вглиб за рахунок просування границі розподілу. Для сферичного зерна це еквівалентно зменшенню з постійною швидкістю V радіуса сфери, що обмежує речовину, яка не прореагувала (рис. 12.6).
Для цього випадку
a = 1 - r3/R3
(1 - a)1/3 = r/R (12.21)
(1 - a)1/3=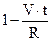
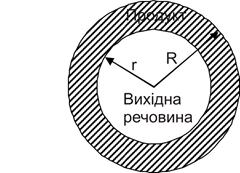
Рисунок 12.6 - Розвиток топохімічної реакції у зерні сферич-
ної форми
Це рівняння сфери, що стискається. Воно дозволяє визначити швидкість просування межі розподілу V, якщо реалізовані умови, для яких виведене рівняння , і якщо всі зерна вихідної речовини мають однаковий розмір R.
За сучасного рівня розвитку кінетики топохімічних реакцій часто важко визначити, якому рівнянню віддати перевагу при обговоренні експериментальних даних. Найбільш правильним, а іноді й єдиним шляхом вибору кінетичного рівняння є спеціальний аналіз моделі, яка закладена у це рівняння, та визначення її застосовності до досліджуваної реакції.
Читайте також:
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Альтернативні уявлення щодо макроекономічного регулювання: теорії раціональних сподівань та економіка пропозиції. Крива Лафера.
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Анімізм – уявлення про існування духовних істот та віра в можливість спілкування з ними.
- Антигени. Антитіла. Серологічні реакції .
- Біогенні аміни та реакції декарбоксилювання
- Види опор та їх реакції
- Визначення очікування індивіду, тобто уявлення індивіду про те, що повинно відбутись.
- Визначення реакції продуктів, кислотності і лужності.
- Вільні осі обертання. Уявлення про гіроскопи
| <== попередня сторінка | | | наступна сторінка ==> |
| Кінетика реакцій за нестаціонарною лінійною дифузією | | | Хімічно незмінними. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |