
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Ключові терміни
Висновки
Введено поняття термодинамічних потенціалів і встановлено, що їхні негативні значення дорівнюють максимальній корисній роботі. Сформульовано термодинамічні умови самодовільності перебігу процесів і умови рівноваги. Виведені рівняння Гіббса-Гельмгольца, що описують температурну залежність роботи. Дано уявлення про третій закон термодинаміки.
СТИСЛИЙ КОНСПЕКТ ЛЕКЦІЙ
У фізичній хімії про напрямок процесу та рівновагу у системі при постійних тиску і температурі роблять висновок за енергією Гіббса або при постійних об¢ємові і температурі – за енергією Гельмгольца.
Запишемо математичні вирази для першого та другого законів термодинаміки: dU = dQ – dA i dQ = TdS.
Отже
dU = TdS - dA
Робота процесу в загальному випадку складається з корисної роботи d¢А та роботи сил розширення: dА=dА¢+PdV. Корисна робота має найбільше значення у зворотному процесі: dАМ = dА¢М + PdV, де А¢М – максимальна корисна робота; АМ – загальна (максимальна) робота процесу. Для зворотного процесу поєднане рівняння першого та другого законів термодинаміки може бути записане так:
dU = TdS - dA¢M – PdV
або
dA¢M = TdS – dU – PdV
При S, V = const рівняння набуває вигляду
-DUS,V =A¢M
При S, P = const -DHS,P = A¢M
При Т, V = const -DFV,T = A¢M
При Т, Р = const -GP,T = A¢M
Функція, спадання якої у зворотному процесі, що проходить при постійних значеннях відповідних параметрів, дорівнює максимальній корисній роботі, називається термодинамічним потенціалом.
Таким чином, чотири функції стану U, H, F i G поєднані загальною назвою – термодинамічні потенціали.
Якщо одиничним видом роботи є робота сил розширення, то можна записати:
dU=TdS-PdV; U=f(S,V),
dH=TdS+VdP; H=f(S,P),
dF=-SdT-PdV; F=f(T,V),
dG=-SdT+VdP; G=f(T,P).
Змінні, від яких залежать термодинамічні потенціали, називаються природними.
Дотепер ми розглядали тільки рівноважні процеси. При нерівноважних процесах dQ < TdS, тому до правої частини рівнянь для диференціалів термодинамічних потенціалів увійдуть більші величини. Іншими словами, при нерівноважних процесах робота буде менша, ніж максимальна робота рівноважного процесу. У загальному випадку маємо
dU £ TdS – PdV,
dH £ TdS + VdP,
dF £ -SdT – PdV,
dG £ -SdT+VdP.
Якщо взяти кожну функцію при сталих природних змінних, то отримуємо
dU £ 0 (S, V = const),
dH £ 0 (S, P = const),
dF £ 0 (T, V = const),
dG £ 0 (T, V = const).
Наведені нерівності є умовами можливості самодомовільного проходження процесів у термодинамічних системах:
у системі можуть довільно проходити тільки процеси, що супроводжуються зменшенням термодинамічних потенціалів (за умови сталості відповідних природних змінних).
Отже, всі довільні процеси ведуть до зменшення термодинамічних потенціалів. Ці процеси припиняться, коли потенціали набудуть мінімальних значень і система перейде у стан рівноваги. Математично ця умова рівноваги має вигляд:
dU = 0, d2U > 0 при S i V = const,
dH = 0, d2H > 0 при S i P = const,
dF = 0, d2F > 0 при T i V = const,
dG = 0, d2G > 0 при T i P = const.
Найбільш важливим для практичного використання є дві останніх умови. До цих умов можна додати умову максимуму ентропії за рівновагою
dS = 0, d2S < 0 при U i V = const, або H i P = const.
Розглянемо енергію Гіббса як функцію температури і тиску: G = f (T, P), а енергію Гельмгольца як функцію температури та об¢єму: F = f (T, V). Отримуємо
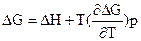 і
і 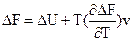 .
.
Ці рівняння називаються рівняннями Гіббса – Гельмгольца. Вони дозволяють виявити температурну залежність роботи, що здійснюється при проходженні будь-якого процесу. Дійсно, при V, T = const DF = -A¢M, DU = QV; при P, T = const DG = -A¢M, DH = QP. Звідси
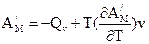 і
і 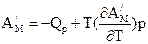 .
.
Треба підкреслити, що QV i QP належать до повністю нерівноважного процесу, в якому робота дорівнює нулю. Робота, що не дорівнює нулю, була отримана у рівноважному процесі. Обидва процеси проходять між тими самими початковим та кінцевим станами. Таким чином, рівняння Гіббса-Гельмгольца встановлюють зв¢язок між тепловими ефектами нерівноважних процесів і максимальними роботами рівноважних процесів.
У 1906 р. В.Нернстом була всловлена гіпотеза про те, що для конденсованих систем не тільки при абсолютному нулі, але й близько від нього значення енергії Гіббса і теплоти реакції однакові. Ця гіпотеза отримала назву теплової теореми Нернста:
DG = QP.
Із теплової теореми Нернста можна отримати низку найважливіших висновків. Наприклад, відомо, що dQ/dT=DС. Тому можна сказати, що при абсолютному нулі алгебраїчна сума теплоємностей конденсованих систем дорівнює нулю:
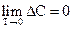 .
.
Це положення Нернст поширив і на самі теплоємності:

Можна показати, що при абсолютному нулі температури змінення ентропії й сама ентропія конденсованих тіл дорівнюють нулю. Висновки із положень теплової теореми обертають її в закон, що називається третім законом термодинаміки. За Нернстом цей закон формулюється так:
у будь-якому ізотермічному процесі, що проходить при абсолютному нулі температури, змінення ентропії системи дорівнює нулю

Відповідно до цього одне з формулювань третього закону термодинаміки може бути таким:
неможливо охолодити систему до температури абсолютного нуля шляхом відведення тепла; абсолютний нуль недосяжний.
Енергія Гіббса; енергія Гельмгольца; термодинамічний потенціал; рівняння Гіббса – Гельмгольца.
Питання для самоперевірки
1. Напишіть вирази енергій Гіббса і Гельмгольца та поясніть, чи є ці функції функціями стану системи.
2. Дайте визначення поняттю термодинамічний потенціал. Напишіть всі вирази, що зв'язують один з одним термодинамічні потенціали.
3. Наведіть вирази для повних диференціалів чотирьох термодинамічних потенціалів.
4. Який фізичний зміст виразів для повних диференціалів термодинамічних потенціалів.
5. Напишіть математичні умови самодовільності процесів.
6. Напишіть математичні умови рівноваги.
7. Виведіть рівняння Гіббса-Гельмгольца.
8. Який фізичний зміст мають рівняння Гіббса-Гельмгольца?
9. Сформулюйте теплову теорему Нернста.
10. Сформулюйте третій закон термодинаміки.
Читайте також:
- Базові (ключові) цінності.
- Безпека» і «небезпека» як ключові категорії в безпеці життєдіяльності
- Видання. Поліграфічне виконання. Терміни та визначення
- Види відповідальності і терміниподання податкової декларації
- Вимоги до керівника-стратега та його ключові компетенції
- Вступ. Основні терміни в галузі метрології
- Вступ. Основні терміни і визначення в галузі стандартизації
- Етап – встановлюють ключові фактори успіху.
- Загальнонаукові терміни
- Класифікація звітності та терміни її подання
- Класифікація реклами. Основні терміни та визначення.
- Ключові визначення
| <== попередня сторінка | | | наступна сторінка ==> |
| У будь-якому ізотермічному процесі, що проходить при абсолютному нулі температури, змінення ентропії системи дорівнює нулю | | | До основних видів діяльності відносяться праця, навчання, гра. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |