
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Основні класи органічних сполук
Таблиця 2.1 – Вуглеводні
| Ознаки порівняння | Алкани (насичені) | Алкени (етиленові) | Алкіни (ацетиленові) | Арени (ароматичні) |
| Загальна формула | СnН2n+2 | СnН2n | СnН2n–2 | СnН2n–6 (похідні бензену) |
| Номенклатура міжнародна IUPAC -суфікс | -ан | -ен | -ин чи -ін | -ен |
| Функціональна група | 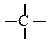
| 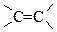
| 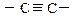
| 
|
| Ізомерія | Карбонового ланцюга. | Карбонового ланцюга, положення положення кратного зв’язку та для алкенів – геометрична. | Положення замісників (якщо їх більше одного). | |
| Гомологічні ряди | СН4 – метан С2Н6 – етан С3Н8 – пропан С4Н10 – бутани С5Н12 – пентани | С2Н4 – етилен С3Н6 – пропілен С4Н8 – бутени С5Н10– пентени | С2Н2 – ацетилен С3Н4 – пропін С4Н6 – бутини С5Н8 – пентини | С6Н6 – бензен С6Н5СН3 – толуен |
| Фізичні властивості | С1-С4 – гази; С5-С16 –рідини; решта – тверді речовини. | С2-С4 – гази; С5-С17 – рідини; решта – тверді речовини. | С2-С4 – гази4 С5-С16 –рідини; решта – тверді речовини. | Безбарвні рідини, що мають характерний запах. |
| У сполук лінійної будови Тпл. і Ткип. зростають зі збільшенням атомів С у молекулах. Газоподібні та тверді не мають запаху, рідкі мають специфічний запах бензину і гасу. Нерозчинні у воді, розчиняються в органічних розчинниках. Густина менша за одиницю. | ||||
| Небезпечність | Газоподібні, у суміші з киснем вибухонебезпечні. | Сильно токсичні. | ||
| Знаходження в природі | Головна складова природного газу і нафти. | Досить рідко у деяких родовищах нафти. |  
| У деяких видах нафти. |
| Застосування | Паливо, пальне для двигунів внутрішнього згорання. Для добування ненасичених вуглеводнів, водню, галогено-похідних та ін. | Виробництво пластмас, етанолу, етиленгліколю та ін. | Виробництво оцтового аль-дегіду і оцтової кислоти. | Виробництво барвників, медикаментів, пластмас, вибухових речовин, інсектицидів і гербіцидів. |
Найбільш характерні властивості вуглеводнів
Алкани
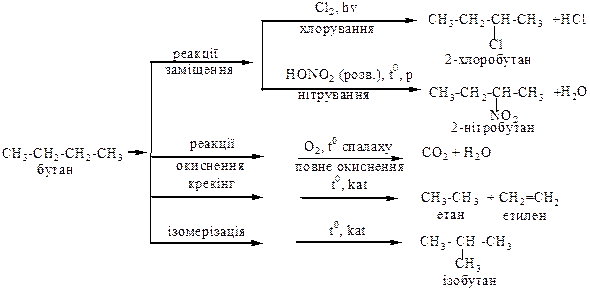
Алкени
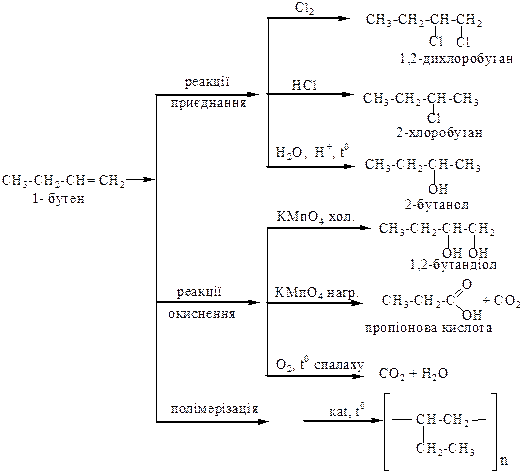
Алкіни
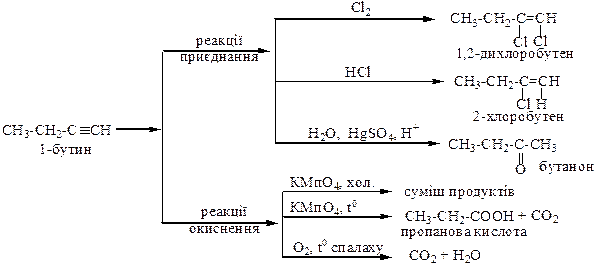
Арени
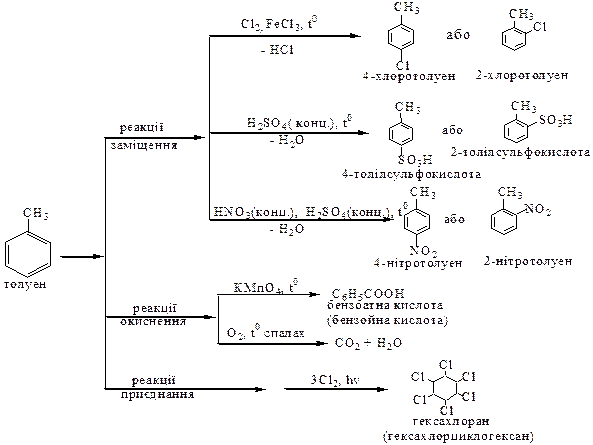
Таблиця 2.2 – Оксигеновмісні органічні речовини
| Ознаки порівняння | Спирти (одноатомні насичені) | Феноли одноатомні | Етери |
| Загальна формула | 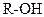
| Ar-OH | R1-O-R2, R-O-Ar, Ar1-O-Ar2 |
| Характеристична група | -ОН – гідроксигрупа біля насиченого атому С | -ОН –гідроксигрупа зв’язана з ароматичним кільцем | -О – зв’язані з однаковими чи різними замісниками |
| Номенклатура - тривіальна - IUPAC | СН3ОН – деревинний; С2Н5ОН – винний. суфікс -ол СН3ОН – метанол; С2Н5ОН – метанол. |
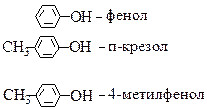
| C2H5-O-C2H5 – дієтиловий етер назва замісників + “етер” диетиловий етер |
| Фізичні властивості | С1-С10 – рідини, з С11 – тверді речовини, легші за воду, безбарвні. С1-С6 – різкий запах. Тверді – без запаху. С1-С3 – добре розчинні у воді. Молекули асоційовані між собою, тому Ткип. вищі за Ткип. сполук інших класів. | Феноли – кристалічні безбарвні речовини, погано розчиняються у воді, окиснюються на повітрі. Розчин фенолу у воді називають карболовою кислотою. | Безбарвні рідини з приємним запахом. У воді не розчиняються. |
| Небезпечність | СН3ОН – 10-20 см3 - сліпота, більша доза смертельна. Надзвичайно токсичний!!! С2Н5ОН – наркотична речовина, великі кількості (0,5-1 дм3) – смертельні! | При попаданні на шкіру чи слизову оболонку – опіки. Вражається кишечник, печінка, жовчний міхур. | С2Н5ОС2Н5 – наркотична речовина. Суміш з киснем – вибухонебезпечна. |
| Застосування | Розчинники. Широко використовують в органічному синтезі (альдегіди, кислоти, естери, етери). | Фенол використовують для одержання фенолформальдегідних смол і інших органічних речовин. | Розчинники |
Продовження таблиці 2.2
| Ознаки порівняння | Оксосполуки | Кислоти (одноосновні насичені) | Естери |
| Загальна формула | 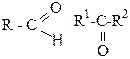
|

| 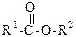
|
| Характеристична група |
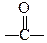 -- оксогрупа -- оксогрупа
|
-СООН – карбоксильна
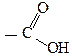
|
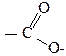
|
| Номенклатура - тривіальна - систематична | 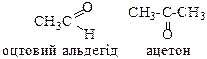 суфікси –аль (альдегіди) чи –он (кетон)
етаналь пропанон
суфікси –аль (альдегіди) чи –он (кетон)
етаналь пропанон
| НСООН – мурашина; СН3СООН – оцтова. суфікс –ова кислота НСООН – метанова кислота; СН3СООН – етанова кислота. |  назва замісників суфікс –оат
етилетаноат
назва замісників суфікс –оат
етилетаноат
|
| Фізичні властивості | С1 – газ, інші оксосполуки – рідини чи тверді речовини з специфічним запахом. Запах альдегідів більш різкий. Оксосполуки легші за воду, нижчі добре розчиняються у воді. | С 1-С3 – безбарвні рідини зз різким запахом. С4-С9 – олієподібні рідини з неприємним запахом. З С11 – тверді речовини, безбарвні. Низькомолекулярні кислоти добре розчинні у воді. | Безбарвні рідини з приємним запахом. У воді не розчиняються. |
| Продовження таблиці 2.2 | |||
| Небезпечність | Токсичні речовини, подразнюють слизову оболонку. | НСООН – при 0,75 мг/дм3 сильне подразнення, сльозоточивість, біль у грудях, кашель, катари шлунка. ГДК (НСООН) – 1 мг/м3. С(СН3СООН) – 2-3 мг/дм3 переносима не більше 3 хвилин. Викликає гострі і хронічні рініти, коньюктивіт. ГДК(СН3СООН) – 5 мг/м3. | Етилетаноат викликає подразнення слизових оболонок (1,44 г/дм3), дерматити, екземи. ГДК – 200 мг/м3. |
| Застосування | Ацетальдегід використовують для одержання пластмас, оцтової кислоти, винного спирту і інших речовин. Ацетон – розчинник. Синтез. | Мурашина кислота – у текстильній і шкіряній промисловості, оцтова – розчинник, виробництво штучних волокон, барвників та ін. | Розчинники |
Найбільш характерні реакції оксигеновмісних
похідних вуглеводнів
Спирти (алканоли)
Феноли
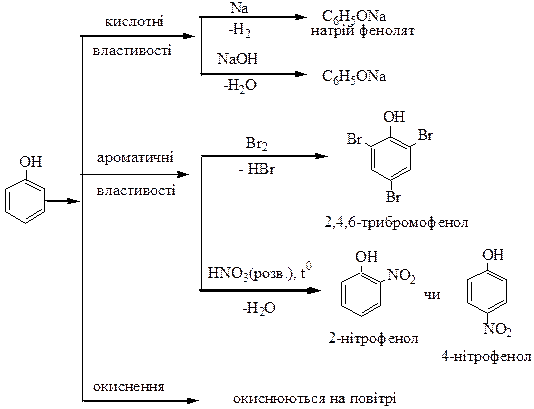
Етери
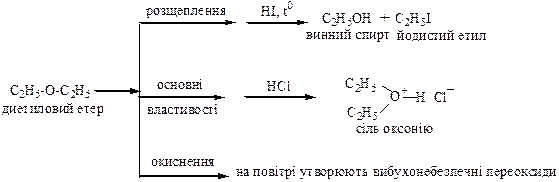
Таблиця 2.3 – Хімічні властивості альдегіів і кетонів
| Представники Реакції | 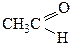 альдегіди
альдегіди
| 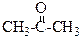 кетони
кетони
|
| 1. Реакції приєднання водню (відновлення) + Н2, Kat 2. Окиснення КМnО4 хол. КМnО4 нагр. | → C2H5OH етанол → СН3СООН оцтова кислота → СН3СООН | → СН3 – СН – СН3 | OH 2-пропанол не окиснюються з розривом ланцюга |
Карбонові кислоти
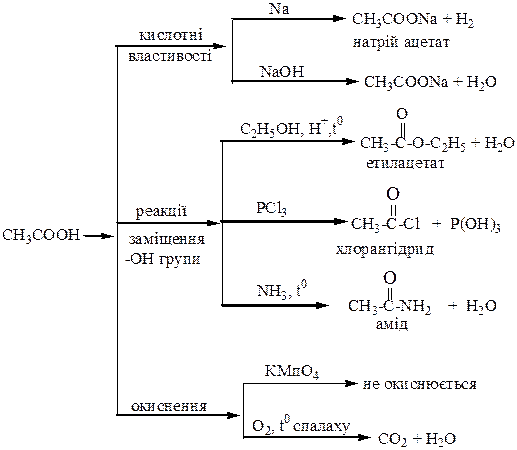
Естери
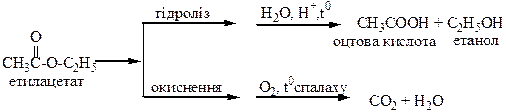
Таблиця 2.4 – Нітрогеновмісні органічні сполуки
| Аміни | Гетероциклічні сполуки | ||
| Представники | CH3NH2 – метиламін C6H5NH2 – анілін |
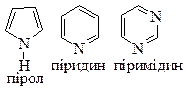
| |
| Фізичні властивості | СН3NH2 – газ з запахом амоніаку C6H5NH2 – рідина з неприємним запахом Нижчі аміни розчиняються у воді. | Рідини безбарвні з неприємним запахом! Розчинні у воді піридини та піримідини. | |
| Хімічні властивості | І Основні властивості
 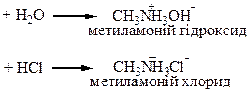 
| ||
ІІ Кислотні властивості
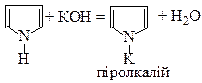
| |||
ІІІ Окиснення
 горять СО2 + Н2О + N2 горять СО2 + Н2О + N2
| |||
| Використання | Для виготовлення ліків, барвників, поверхневоактивних речовин. | Для виготовлення барвників та kіків. | |
| Небезпечність | Дуже токсичні речовини. Канцерогени. Токсичність зростає з ростом карбонового ланцюга. Навіть у малих концентраціях вражають нервову систему, впливають на кровотворненя, порушують функції печінки. Рідкий анілін всмоктується крізь шкіру зі швидкістю 0,2-0,7 г/см2/год. ГДК метиламіну – 1 мг/м3. ГДК аніліну – 0,1 мг/см3. | Пара піридину – сильний подразник, викликає сильно токсичну дію. В першу чергу вражає нервову систему, викликає дегенеративні зміни у печінці і нирках. ГДК піридину – 5 мг/м3. | |
Таблиця 2.5 – Галогеновмісні органічні сполуки
| Склад | СНСl3 хлороформ | ССl4 чотирихлористий карбон | CF2Cl2 дифлуоро-дихлоро- метан | СН2=СНСl хлористий вініл |
| Фізичні властивості | Безбарвна рідина, солодкуватий запах. | Негорюча безбарвна рдина, солодкуватий запах. | Газ, без кольору та запаху. | Безбарвний газ. |
| Густина більша за одиницю. Нерозчинні у воді. | ||||
| Хімічні властивості моногалогено похідних |
І. Реакції заміщення:
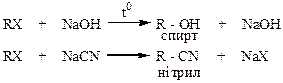 ІІ. Реакції відновлення:
ІІ. Реакції відновлення:
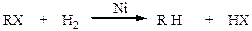
| |||
| Небезпечність | У присутності кисню розкла- дається з утво-ренням СОСl2 – фосгену (отруй-ний газ). Раніше використовував- ся як дихальний загальнонаркотич ний засіб, але виявлена побічна дія на серце і печінку. | При температурі вище за 5000С утворюється фосген. | Нетоксичний, вибухо-небезпечний. | ГДК = 0,1мг/м3 Канцерогенна речовина – пухлини печінки, системи крові та лімфи. |
| Застосування | Добрі розчинники | |||
| Одержання фреонів, тефлону. | Одержання фреонів. Негорючий розчин- ник. | Фреон (фреон-12) – хладоагент у холодильниках. Розчинник інсектицидів. | Одержання полівінілхлориду з якого виготовляють електро-ізоляційні матеріали, замінник шкіри, лінолеум тощо. |
Високомолекулярні сполуки (ВМС)
ВМС поділяють на природні (білки, нуклеїнові кислоти, полісахариди) та синтетичні.
Макромолекула полімеру побудована з однакових фрагментів (мономерних одиниць). Структурний елемент – найменша група атомів полімерного ланцюга, що повторюється (табл. 2.6).
Таблиця 2.6 – Будова ВМС
| Полімер | Мономер | Структурний фрагмент (ланка) | Структурний елемент |
| Поліетилен | 
| 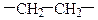
| 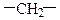
|
| Полістирен | 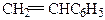
| 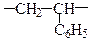
| 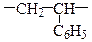
|
Число структурних фрагментів в макромолекулі називається ступінню полімеризації (n): [– СН2 – СН2 – ]n.
Більшість синтетичних полімерів утворена одним чи двома видами структурних фрагментів.
Найважливіші синтетичні полімери – це поліетилен, поліпропілен, полістирен, поліізобутилен, полібутадієни, полівінілхлорид, тефлон, поліакрілонітрил, поліметилметакрилат, епоксидні смоли, силікони, фенолформальдегідні смоли, сечовинформальдегідні смоли тощо.
Каучуки можуть бути натуральними і синтетичними (натрійбутадієновий, ізопреновий, хлоропреновий).
Натрійбутадієновий каучук відноситься до каучуків загального призначення і одержується полімерізацією бутадієну:
пСН2 = СН – СН = СН2 → [– СН2 – СН = СН – СН2–]п
Умови реакції: підвищений тиск та температура, натрій.
Ізопреновий каучук одержують з ізопрену:
пСН2 = С(СН3) – СН = СН2 → [– СН2 – С(СН3) = СН – СН2–]п
Хлоропреновий каучук одержують з хлоропрену:
пСН2 = С(Сl) – СН = СН2 → [– СН2 – С(Сl) = СН – СН2–]п
Цей каучук дуже стійкий до впливу світла, розчинників. Використовують для виробництва деталей та апаратури.
У теперішній час синтетичні полімери перестали бути замінниками природних речовин і є матеріалами, що за властивостями перевершують природні аналоги. У той же час, синтетичні полімери – це дуже інертні матеріали. Вони стійкі до впливу зовнішнього середовища і є біологічно жорсткими, що призводить до забруднення ними навколишнього середовища.
Поверхнево-активні речовини (ПАР)
До ПАР відносять речовини, які здатні знижувати поверхневе напруження рідин, особливо, води. Вони містять гідрофобний вуглеводневий залишок і гідрофільну группу атомів.
Щорічно майже половина ПАР використовується для виробництва миючих засобів, засобів для чистки, інша половина – це емульгатори, деемульгатори, інгібітори корозії, флотаційні засоби.
В залежності від заряду гідрофільної групи ПАР поділяють на:
- аніоноактивні (мило, синтетичні миючі засоби);
- катіоноактивні (флотаційні агенти, дезінфікуючі засоби);
- неіоногенні (компоненти різних миючих засобів);
- амфолітні (шампуні для волосся, дитячі шампуні).
До біологічно жорстких ПАР відносять алкілбензенсульфонати з розгалуженим алкільним замісником. ПАР такої будови у стічних водах дуже повільно руйнуються мікроорганізмами і довго забруднюють воду. Тому у більшості країн їх використання заборонено.
Сучасні миючі засоби містять поліфосфати, які підсилюють миючу дію ПАР. Однак, наявність фосфатів у миючих засобах призводить до збагачення фосфором природних вод і, як наслідок, – надмірному росту водоростей і водних рослин.
Література
1. Бобровник Л.Д., Руденко В.М., Лезенко Г.О. Органічна хімія. – К.: Ірпінь: ВТФ “Перун”. – 2005. – 544 с.
2. Жиряков В.Г. Органическая химия. – М.: Химия. – 1972. – 408 с.
3. Мітрясова О.П. Вступ до органічної хімії. – К.: ВД “Професіонал”. – 2007. – 400 с.
4. Нечаев А.П. Органическая химия. – М.: Высш. шк. – 1988. – 319 с.
5. Тейлор Г. Основы органической химии для студентов нехимических специальностей. – М.: Мир. – 1989. – 384 с.
6. Цвєткова Л.Б., Романюк О.П. Неорганічна і органічна хімія. – Львів: “Магнолія – 2006”. – 2007. – 358 с.
Читайте також:
- II. Класифікація видатків та кредитування бюджету.
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- II. Основні засоби
- II.3. Основні способи і прийоми досягнення адекватності
- V. Класифікація і внесення поправок
- V. Класифікація рахунків
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- А .Маршалл - основоположник неокласичної теорії.
- А. Структурно-функціональна класифікація нирок залежно від ступеню злиття окремих нирочок у компактний орган.
- Абстрактні класи
- Адвокатура в Україні: основні завдання і функції
- Адміністративні провадження: поняття, класифікація, стадії
| <== попередня сторінка | | | наступна сторінка ==> |
| Теоретичні засади органічної хімії | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |