
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Електроліз розчинів і розплавів
Отже, електричний струм в електролітах являє собою спрямований рух іонів в електричному полі. На відміну від металів і напівпровідників проходження електричного струму через електроліт супроводжується переносом маси речовини.
Процеси в електролітах підкоряються закону Ома.
В електроліті густина струму пропорційна напруженості електричного поля. Провідність електроліту збільшується з ростом концентрації іонів і їхньої рухливості.
Зі збільшенням температури, провідність електролітів росте, що зумовлюється збільшенням рухливості (зменшенням в'язкості рідини) і зростанням ступеня дисоціації.
Явище виділення речовини на електродах при проходженні через електроліт струму, а також процеси окислювання чи відновлення на електродах, що супроводжуються набуттям чи утратою частками речовини електронів, називаються електролізом.
У промисловості електроліз застосовується в основному для анодного розчинення металу і його катодного осадження з розчинів і розплавів.
 Речовини, у яких нормальний потенціал більше —1 стосовно потенціалу нормального водневого електрода, одержують шляхом електролізу розчинів (мідь, цинк). Метали з нормальним потенціалом менше —1 одержати таким способом не вдається. Тому при їхньому виробництві застосовують електроліз розплавів солей цих металів (літій, калій, алюміній, магній).
Речовини, у яких нормальний потенціал більше —1 стосовно потенціалу нормального водневого електрода, одержують шляхом електролізу розчинів (мідь, цинк). Метали з нормальним потенціалом менше —1 одержати таким способом не вдається. Тому при їхньому виробництві застосовують електроліз розплавів солей цих металів (літій, калій, алюміній, магній).
Якщо в електролізній ванні процес відбувається з поглинанням електричної енергії,ваннаназивається електролізером.
Принципова схема електролізера показана на рис.12.1.
На аноді перехід металу з металевого стану (Ме°) в іонне відбувається в результаті віддачі металів електронів Ме°—пе—-Меп+ (анодне розчинення), де п — число одиничних зарядів. На катоді іон здобуває електрони і переходить у металевий стан Меп++пе-Ме° (катодне осадження).
Електроліз міді. Метою електролізу міді є зниження вмісту домішок у чорновій міді, отриманою плавкою у відбивних печах, витяг шляхетних і інших коштовних металів, що знаходяться в ній і одержання чистої електролітичної міді.
Процес проводять в електролізних ваннах ящикового типу. У ванні встановлюються литі аноди чорнової міді, між якими підвішуються тонкі пластини чистої міді (катоди). Після цього у ванну подають електроліт, що являє собою водяний розчин мідного купоросу, підкислений сірчаною кислотою для зменшення опору.
Відлиті з чорнової міді аноди являють собою плити прямокутної форми товщиною 35—45 мм і масою близько 300 кг. Катоди виготовляють з листової електролітичної міді товщиною 0,6—0,7 мм. Для надягання на штанги при підвішуванні у ванни до катодів приварюють вушка, відстань між поверхнями сусідніх анодів і катодів складає 35—40 мм.
При пропущенні через ванну постійного електричного струму відбувається розчинення чорнової міді анодів і осадження чистої міді Cu на катодах. Шляхетні метали і деякі домішки у виді шлаку випадають в осад, деякі інші домішки (нікель) переходять у розчин.
Процес електролізу починається при напрузіна ванні 0,3—0,35 В. Густина струму обмежується умовою одержання дрібнозернистого, щільного і гладкого осаду катодної міді. У залежності від складу чорнової міді густина струму коливається в межах 180—270 А/м2. Фактичний вихід по струму складає 92—98 %. Питома витрата електроенергії складає 200— 379 квт-г/т чистової міді.
Катоди й аноди у ваннах включають паралельно, а ванни послідовно. Послідовне включення електродів у ванні (система серій) застосовується вкрай рідко. У процесі електролізу змінюється концентрація іонів в електроліті в різних частинах ванни, що може привести до збільшення витрати електроенергії. З метою вирівнювання концентрації іонів міді в електродів і забезпечення необхідної температури застосовується пряма циркуляція електроліту, при якій він подається знизу ванни і зливається зверху.
Температура електроліту підтримується на рівні 333±ЗК. Необхідний підігрів електроліту здійснюється за допомогою теплообмінників із графіту, титана чи нержавіючої сталі.
При проведенні електролізу в електролізних ваннах прагнуть до максимального виходу міді по струму, зниженню питомої витрати електроенергії і збільшенню їхньої продуктивності.
Зниження виходу металу по струму є наслідком витоку струму, появі якого сприяють несприятливі умови в електролізних цехах: підвищені кислотні випари; вогкість дерев'яних частин ванни; відкладення солей на деталях ванн; порівняно високий потенціал ванн щодо землі.
Шляхами витоку струму на електролізних установках можуть бути:
а) циркуляційні магістралі електроліту; б) магістралі веди і пара; в) ізоляція ванн від землі; г) ізоляція між ваннами; д) провідна футеровка ванн; е) короткі замикання між електродами.
Електроліз цинку. Високоякісний цинк одержують шляхом електролізу водяних розчинів його солей. У ваннах встановлюються алюмінієві катоди і свинцеві аноди. Потім вони заповнюються водяним розчином сірчанокислого цинку ZnSO4(5-6%) , що дисоціює на катіони цинку Zn2+ і аніони S04 і сірчані кислоти Н2S04.
, що дисоціює на катіони цинку Zn2+ і аніони S04 і сірчані кислоти Н2S04.
Під час електролізу на катоді осаджується металевий цинк, на аноді виділяється газоподібний кисень, а в розчині утвориться сірчана кислота Н2S04.
Щоб забезпечити осадження цинку на катоді, електроліз проводять при підвищеній густині струму (400—600 А/м2) і додають у розчин поверхнево-активні речовини, що перешкоджають виділенню водню на катоді.
В електролізних цехах застосовують ванни зі збірного залізобетону (іноді сталеві) із захистом з кислототривких матеріалів. Обортовку ванн і зливальні короби виконують з вініпласту. Зовні ванни покривають кислототривкою фарбою, бітумом чи гумою (по сталі). У дні ванн знаходиться отвір для випуску шламу. Ванни довгими бортами встановлюють поруч, з'єднують у блоки по 20—30 ванн.
Для одержання високого виходу по струму температуру електроліту необхідно підтримувати на рівні 308—313 К. На практиці застосовується індивідуальне для кожної ванни охолодження електроліту за допомогою алюмінієвих чи кисневих змійовиків.
У виробництві цинку вихід по струму складає звичайно 88— 94%, витрата електроенергії 3500 квт-ч на 1 тону цинку.
Опір електроліту визначається його температурою і концентрацією цинку в розчині. Різке підвищення спадання напруги на ванні (до 3,3—3,6 В) указує на необхідність очищення анодів від шламу.
Аноди виготовляють зі свинцю з добавкою 1% срібла для зниження корозії. Товщина анодних пластин 5—8 мм. Катоди виготовляють з листового алюмінію товщиною 4 мм.
Здирку цинку з алюмінієвих катодів роблять раз у добу чи раз на дві доби. Вони піддаються систематичному очищенню один раз у 10 днів на катодоочистній машині. Аноди очищають один раз у 20—25 днів. Знос катодів складає близько 1,5 кг, а анодів — 0,8—1,5 кг на 1 т цинку.
Отримані пластини катодного цинку промивають водою, формують у пакети і потім переплавляють в індукційних канальних печах.
Електроліз алюмінію. При нормальному потенціалі виділення металу менше —1 В осадити його на катоді методом електролізу розчину неможливо, тому що на катоді будуть виділятися в основному водень і домішки, які містяться в електроліті й аноді. Так як нормальний потенціал алюмінію-1,67 В, то його одержують шляхом електролізу розплавлених солей. У цьому випадку електролітом є розчин оксиду алюмінію А120з у розплавленому кріоліті (Nа3 А1F6).
Оскільки фторидні розплави є сильно агресивними середовищами, електроліз алюмінію проводять з вугільним електродом, що витрачається, а внутрішні поверхні ванн футеруют вугільними плитами і блоками.
Електролізери для одержання алюмінію можна класифікувати по ряду ознак:
1.По потужності (силі струму): 40-50 кА — малої потужності;
60-80 кА — середньої потужності; 100-160 кА — великої потужності; 200-250 кА — надвеликої потужності.
2. По способу підведення струму: бічний — електролізери малої і середньої потужності; верхній — електролізери великої потужності.
3. По конструкції анода: самоспікливий за рахунок теплоти ванни й обпалений. Обпалені аноди мають тільки верхнє підведення струму. Самоспікливі аноди встановлюють по одному на кожній ванні. Принциповий пристрій електролізної ванни для одержання алюмінію показано на рис.12.2.
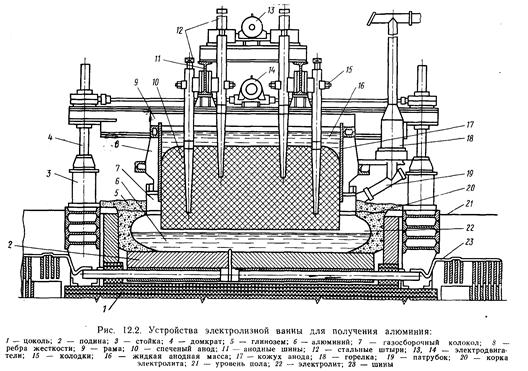 Ванни мають прямокутну форму. Корпус електролізера зварений зі сталевих аркушів, може бути з днищем і без днища. Корпус ванни знизу частково заповнений шамотною кладкою для теплоізоляції. На ній установлюють подові катодні блоки, до яких кріплять спеціальні струмопроводи — блюмси. Бічні сторони покривають азбестовим листом, теплоізолюють глинозимовим засипанням і футеруют вугільними плитами. Усі шви у вугільній кладці заповнюють углеродистой масою. З метою ослаблення дії магнітних полів на розплавлений алюміній застосовується двостороння підводка струму.
Ванни мають прямокутну форму. Корпус електролізера зварений зі сталевих аркушів, може бути з днищем і без днища. Корпус ванни знизу частково заповнений шамотною кладкою для теплоізоляції. На ній установлюють подові катодні блоки, до яких кріплять спеціальні струмопроводи — блюмси. Бічні сторони покривають азбестовим листом, теплоізолюють глинозимовим засипанням і футеруют вугільними плитами. Усі шви у вугільній кладці заповнюють углеродистой масою. З метою ослаблення дії магнітних полів на розплавлений алюміній застосовується двостороння підводка струму.
Розміри анода визначаються заданою потужністю ванни і припустимою щільністю струму, що для ванн середньої потужності складає 0,80—0,95 А/см2, а на потужніх ваннах знижується до 0,65—0,7 А/см2. Обпалені аноди працюють при щільностях струму 0,75—1,0 А/см2.
Основною перевагою самоспікливих електродів є економія витрат на пресування і випал електродів. До їхніх недоліків варто віднести виділення шкідливих газів у цеху електролізу з кожної ванни, високий опір, викрашування, унаслідок чого виникає необхідність знімати з електроліту вугільну крихту — піну.
Анод підвішують на рухливій рамі, що переміщається по металоконструкціях печі. Автоматичне переміщення анода здійснюється у функції втрати напруги в електроліті.
Струм до ванни підводиться з двох сторін по пакетах алюмінієвих шин. Від шин до штирів струм підводиться по гнучких мідних струмопроводах, а безпосередньо в масу анода струм вводиться за допомогою сталевих штирів. У випадку верхньої підводки струму до анода штир і шина з'єднуються колодкою з пружинним затиском.
Електролізери поєднують у серію з 160—170 шт., причому 4—3 з них резервні. Ванни серії звичайно встановлюють у двох корпусах у два ряди в кожнім. Підлоги електролізного цеху виконують електроізольованими.
При електролізі розплавів струм через ванну досягає значень більш 100кА, тому ванни .включають у серії послідовно без попереднього об'єднання в блоки. З'єднання окремих ванн чи блоків між собою в серії, а також підключення їх до джерел живлення виконується шинопроводами.
При нормальній роботі напруга на ванні складає 4,2— 4,5 В, що досягається підтримкою заданого складу електроліту і режимних показників.
При недостачі глинозему (0,5—1,5%) починає проявлятися анодний ефект. Напруга на ванні спочатку поступово, а потім різко зростає до 50—60 В. Ефект супроводжується яскравим світінням, рясним виділенням газу і пару, перегрівом електроліту, що спричиняє утрату фтористих солей і перевитрату електроенергії. Ефект ліквідують добавкою глинозему в електроліт.
Виливку металу з ванни роблять за допомогою вакуум-ковша. Вилитий з ванн алюміній надходить у міксери ливарного корпуса, де він після усереднення і відстоювання розливається в злитки.
Виробництво алюмінію є енергоємним. Фактична витрата електроенергії на виробництво алюмінію складає 14000—16000 квт-г/т. Вихід металу на 1 квт-г складає 60— 77 м, що типово для питомої витрати електроенергії (16000± ±500) квт-г на 1 т алюмінію.
Читайте також:
- Агрегативна стійкість і коагуляція колоїдних розчинів
- Визначення нормальності робочих титрованих розчинів
- Властивості будівельних розчинів
- ДИСПЕРГУВАННЯ РОЗПЛАВІВ
- До фізико-хімічних методів очищення стічних вод належать: коагуляція, сорбція (абсорбція, адсорбція), мембранні методи, іонний, обмінні, електроліз, екстракція.
- Електричні властивості колоїдних розчинів
- Електроліз розчинів та розплавів.
- Електроліз – сукупність окисно-відновних процесів, що протікають на поверхні електродів при проходженні постійного електричного струму через розплав чи розчин електроліту.
- Електроліз.
- Електроліз.
- Електроустаткування електролізних виробництв.
| <== попередня сторінка | | | наступна сторінка ==> |
| Основи електрохімічної обробки | | | Електроустаткування електролізних виробництв. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |