
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Електроліз – сукупність окисно-відновних процесів, що протікають на поверхні електродів при проходженні постійного електричного струму через розплав чи розчин електроліту.
Електроліз
Пристрої, в яких електричний струм від зовнішніх джерел витрачається для здійснення на електродах окисно-відновних реакцій, називають електролізерами, де відбуваються електролізні процеси. Електрод, на якому відбувається процес відновлення, називається катодом, а електрод на якому відбувається процес окиснення– анодом. Механізми процесів відновлення і окиснення залежать від хімічного характеру електроліту, його стану, природи електродів та інших факторів. Тому необхідно розглядати окремо процеси електролізу розплавів і розчинів, а також процеси електролізу з інертним і активним (металевим) анодами.
Інертні аноди виготовляють із платини, іридію або їх сплавів, а також із графіту або вугілля. У процесі електролізу вони не розчиняються.
При електролізі розплавів на катоді відновлюються катіони, а на аноді окиснюються аніони електроліту. Н а п р и к л а д:
1) Електроліз розплаву натрій хлориду. При проходженні електричного струму крізь розплав натрій хлориду катіони Натрію під дією електричного поля пересуваються до негативного електрода (катода), де відбувається їх відновлення. Аніони Хлору пересуваються до позитивного електрода (анода), де віддають електрони, тобто окиснюються – це перша стадія. На другій стадії – утворюється молекула хлору з атомів. Схема електролізу має вигляд:



 NaCl ⇄ Na+ + Clˉ
NaCl ⇄ Na+ + Clˉ
(–) Катод Анод (+)
Na+ + еˉ = Na 2Clˉ = 2Cl + 2еˉ
2Cl = Cl2 .
Сумарне рівняння окисно-відновної реакції, яка проходить при електролізі розплаву натрій хлориду має вигляд:
2Na+ + 2Cl ˉ = 2Na + Cl2.
2) Схема електролізу розплаву кальцій гідроксиду:



 Сa(ОН)2 ⇄ Сa2+ + 2ОНˉ
Сa(ОН)2 ⇄ Сa2+ + 2ОНˉ
(–) Катод Анод (+)
Сa2+ + 2еˉ = Сa 4ОНˉ = 2Н2О + О2 + 4еˉ.
При електролізі водних розчинів на катоді відбувається відновлення окисників у порядку зменшення їх електродних потенціалів.
При електролізі водних розчинів потрібно враховувати величину потенціалу процесу відновлення йонів Гідрогену. Цей потенціал залежить від концентрації йонів Гідрогену і у випадку нейтральних розчинів (рН=7) φ = –0,059 ∙ рН = –0,41 В.
Таким чином, на катоді можливі три випадки:
1. Відновлення в першу чергу окисників, у яких електродні потенціали вищі, ніж потенціал водневого електрода. Це катіони Au+, Ag+, Cu2+, платинових металів. Відновлення відбувається за схемою:
Mez+ + zеˉ = Me.
Н а п р и к л а д при електролізі водного розчину купрум(ІІ) хлориду на катоді відбувається відновлення йонів Cu2+:
Cu2+ + 2еˉ = Cu.
2. Відновлення катіонів металів, потенціал яких нижчий, ніж у водневого електрода (починаючи приблизно від стануму), але виший, ніж у титанового (метали середньої части ряду напруг: Zn, Cr, Fe, Cd, Ni). З урахуванням концентрації розчину і умов електролізу (густини струму, температури, складу розчину) можливе одночасне відновлення з катіонами металів і йонів Гідрогену (в кислому середовищі):
2Н+ + 2еˉ = Н2↑
або відновлення молекул води (в нейтральному і лужному середовищі):
2Н2О + 2еˉ = Н2↑ + 2ОНˉ.
Н а п р и к л а д, при електролізі водного розчину цинк сульфату на катоді відбувається і відновлення йонів Zn2+:
Zn2+ + 2еˉ = Zn
і відновлення молекул води:
2Н2О + 2еˉ = Н2↑ + 2ОНˉ.
3. Відновлення молекул води, якщо водний розчин солей містить катіони металів, у яких потенціали нижчі, ніж у титану:
2Н2О + 2еˉ = 2ОНˉ + Н2↑.
Н а п р и к л а д, при електролізі водного розчину калій сульфату на катоді відбувається відновлення молекул води.
Характер реакцій на аноді залежить від присутності води, pH середовища і матеріалу анода. У водних розчинах електролітів на інертному аноді спочатку окиснюються найбільш сильні відновники, тобто речовини з найменшим електродним потенціалом, наприклад, сульфід-іон, галогенід-іони та ін. Потім у лужному середовищі окиснюються гідроксид-іони:
4ОНˉ = О2↑ + 2Н2О + 4еˉ φº = 0,401 В,
а в кислому або нейтральному середовищі окиснюються молекули води, якщо в розчині є оксигеновмісні аніони: SO42ˉ, NO3ˉ, ClO3ˉ, PO43ˉ:
2H2O = O2↑ + 4H+ + 4еˉ φº = 1,228 B.
Послідовність окиснення аніонів і молекул на інертному аноді можна показати у вигляді такого ряду:
| S2ˉ, Iˉ, Brˉ, Clˉ, OHˉ, H2O | SO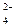 , NO , NO , ClO , ClO , PO , PO
|
| у водних розчинах не окиснюються |
При проведенні електролізу з активним анодом матеріал аноду розчиняється:
Me = Mez+ + zеˉ.
Н а п р и к л а д, при електролізі водного розчину нікол(ІІ) сульфату з нікелевим анодом на катоді відбувається головним чином разряд йонів Ni2+ і виділення металу, а на аноді – окиснення металу (розчинення), так як потенціал ніколу менше потенціалу окиснення води і потенціалу окиснення йону SO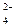 .
.



 NіSO4 ⇄ Nі2+ + SO
NіSO4 ⇄ Nі2+ + SO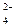
(–) Катод Анод (+)
Nі2+ + 2еˉ = Nі Nі = Nі2+ + 2еˉ.
Цей процес застосовується для електролітичної очистки нікелю (електролітичне рафінування).
Кількісно процеси електролізу визначаються законами Фарадея.
Згідно з перший законом Фарадея, маса електроліту, що піддається перетворенню при електролізі, а також маси речовин, що виділяються на електродах, прямо пропорційні кількості електрики, що пройшла через розчин чи розплав електроліту.
За другим законом Фарадея, однакової кількості електрики, що проходять крізь розчини різних електролітів, під час електролізу виділяють еквівалентні кількості речовин.
Проведення процесу електролізу завжди викликає виникнення деякої різниці потенціалів, направленої протилежно тій, яка накладається зовні. Це явище одержало назву поляризація. Розрізняють хімічну і концентраційну поляризації.
Хімічна поляризація виникає внаслідок того, що виділення продуктів електролізу призводить до утворення гальванічного елемента.
Н а п р и к л а д, при електролізі розчину сульфатної кислоти водень і кисень, які виділяються відповідно на катоді і аноді, утворюють воднево-кисневий елемент, виникнення якого протидіє електролізу.
Концентраційна поляризаціяпов’язана з тим, що в процесі електролізу концентрації електроліту в катодному і анодному просторах змінюються і стають різними.
Н а п р и к л а д, при електролізі розчину Ніколу з двома нікелевими електродами концентрація розчину в катодному просторі зменшується, а в анодному – збільшується. Виникає концентраційний елемент, е. р. с. якого направлена протилежно накладеній різниці потенціалів.
Поляризація електродів збільшує витрату електричної енергії при електролізі, тому її намагаються якомога знизити.
Послабити концентраційну поляризацію можливо шляхом перемішування електроліту або обертанням електродів. Але цілком позбутися концентраційної поляризації не можна, тому що біля електрода завжди є дуже тонкий шар розчину, в якому рідина практично не перемішується. Щоб зменшити концентраційну поляризацію, електроліз проводять в насичених розчинах з надлишком твердої фази.
Для усунення хімічної поляризації необхідно повністю видаляти з електродів продукти електролізу, що призводять до виникнення елемента з протилежною е. р. с. З цією метою використовують хімічні деполяризатори. Так, для деполяризації катода застосовують окисники, які зв’язують водень, що виділяється на катоді (MnO2, K2Cr2O7 та ін.). Для деполяризації анода, навпаки, необхідні відновники, що зв’язують кисень (наприклад, етанол, який окиснюється на аноді до оцтової кислоти).
Мінімальна різниця потенціалів, яку треба створити, щоб електроліз відбувся, називається напругою розкладання Ер, а різниця між напругою розкладання і е. р. с. (Е) утвореного гальванічного елемента називається перенапругою ΔU, тобто
ΔU = Ер – Е.
Величина перенапруги ΔU залежить від матеріалу електродів, концентрації електроліту тощо.
Для врахування частини електрики, що пройшла через електроліт і витратилась на добування бажаного продукту введено поняття вихід за струмом.
Електроліз широко застосовується у металургійній та хімічній промисловості. Електролізом розплавів одержують лужні, лужноземельні метали та алюміній.
Електролізом водних розчинів солей одержують цинк, кадмій, мідь та деякі інші метали. Електрохімічне рафінування металів використовують для одержання чистих металів (міді, олова, свинцю, срібла). Процеси електроосадження використовують для покриття поверхні одного металу іншим.
Читайте також:
- H) інноваційний менеджмент – це сукупність організаційно-економічних методів управління всіма стадіями інноваційного процесу.
- Автоматичне розвантаження по струму.
- Агрегативна стійкість і коагуляція колоїдних розчинів
- Адміністративні методи - це сукупність прийомів, впливів, заснованих на використанні об'єктивних організаційних відносин між людьми та загальноорганізаційних принципів управління.
- Адсорбція на межі розчин – газ.
- Адсорбція на межі тверде тіло – розчин.
- Активний опір у ланцюзі синусоїдального струму
- Акустичний контроль приміщень через засоби телефонного зв'язку
- Алгоритм розрахунку температури поверхні чипу ІМС процесора
- Аналіз ризику через моделювання.
- Баланс потужностей у колі гармонічного струму.
- Безпечні методи звільнення потерпілого від дії електричного струму.
| <== попередня сторінка | | | наступна сторінка ==> |
| Ряд електрохімічних потенціалів металів | | | Корозія – це окисно-відновний процес руйнування металів у результаті їх фізико-хімічної взаємодії з навколишнім середовищем, який протікає самодовільно. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |