
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Добуток розчинності
Якщо кристали малорозчинної солі побудовані з йонів, то у розчин переходять не молекули, а йони солі. Для малорозчинної сполуки, наприклад ВаSO4 або AgCl, що перебуває у рівновазі із своїм насиченим розчином, рівняння динамічної рівноваги матиме вигляд:
ВаSO4 = Ва2+ +SO42-,
Тверда фаза Насичений розчин
тобто при сталій температурі за одиницю часу у розчин переходить така кількість солі, яка за той самий час із розчину випадає в осад (тверду фазу).
Для наведеного вище оборотного процесу при сталій температурі можна записати:
[Ва2+] • [SO42-] = K
де К — константа рівноваги.
З цього рівняння випливає, що у насиченому при певній температурі розчині добуток концентрацій йонів малорозчинного електроліту є сталою величиною, яка називається добутком розчинності і позначається ДР. Тоді для насиченого розчину ВаSO4 (при 25°С) рівняння запишеться як:
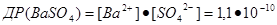
Наприклад, для малорозчинних у воді солей Ag2S і Ва3(РО4)2 маємо:
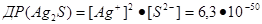
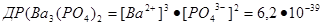
Значення ДР погано розчинних у воді сполук можна обчислити ва їх розчинністю.
Оскільки ДР сполуки при певній температурі є сталою величиною, то збільшення концентрації у розчині одного з йонів, на які дисоціює сполука, призводить до зменшення концентрації другого. Так, якщо до насиченого розчину ВаSO4 добавити розчин сполуки, яка містить йон SO42-, то рівновага порушується і, згідно з принципом ЛеШательє, вона зміститься вліво, тобто з розчину почне випадати ВаSO4. Те саме відбувається і при введенні в насичений розчин ВаSO4 надлишку йонів барію.
Отже, введення однойменних йонів в розчин малорозчинного електроліту знижує його розчинність. Цей висновок має велике практичне значення, зокрема у кількісному аналізі, оскільки дає змогу практично повністю осаджувати той чи інший йон у вигляді малорозчинної сполуки.
Умови виділення і розчинення осадів:
1.Якщо [К+] • [А-] < ДР, то розчин ненасичений і осад розчиняється;
2.Якщо [К+] • [А-] = ДР, то розчин насичений і система в стані рівноваги;
3.Якщо [К+] • [А-] > ДР, то розчин пересичений і осад випадає.
Читайте також:
- Векторний добуток векторів
- Векторний добуток векторів.
- Векторний добуток і його властивості.
- Вуглевидобуток в Україні та перспективи його розвитку
- Де - місячний видобуток руди у кар’єрі, млн.т.
- Декартів добуток
- Дисоціація води. Йонний добуток води
- Дисоціація води. Йонний добуток води.
- Добуток ланцюгових темпів зростання становить базовий темп зростання.
- Добуток розчинності.
- Комплексною оцінкою небезпеки є ризик (R), який визначається як добуток частоти виникнення небезпеки на шкоду, що вона завдає.
| <== попередня сторінка | | | наступна сторінка ==> |
| Коефіцієнти активності речовин і іонів є функцією не лише концентрації розчину. Їхні значення також залежать від природи електроліту, температури та йонної сили розчину. | | | Дисоціація води. Йонний добуток води |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |