
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Коефіцієнти активності речовин і іонів є функцією не лише концентрації розчину. Їхні значення також залежать від природи електроліту, температури та йонної сили розчину.
Під активністю розуміють величину, яку треба підставити у термодинамічне рівняння замість концентрації, щоб обчислені значення збігалися з експериментальними.
У рівнянні С — концентрація, яка виражається в одиницях молярності або моляльності; f — коефіцієнт активності, тобто коефіцієнт, на який треба помножити величину концентрації, щоб дістати значення активності. Він є мірою розбіжності активності і концентрації або мірою відхилення стану електроліту у реальному розчині від cтану того самого електроліту в ідеальному розчині, де немає міжйонної взаємодії. Чим ближче реальний розчин до ідеального, тим ближчі між собою концентрація і активність. Коли концентрація розчину дорівнює 10-3 - 10-4 моль/л, то а=С, а коефіцієнт активності наближається до одиниці.
Йонна сила розчину є півсумою добутку концентрацій усіх йонів у розчині на квадрат їхнього заряду z:
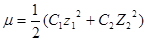
Вважають, що при сталому значенні йонної сили розчину коефіцієнти активності йонів також залишаються сталими і не залежать від їхньої концентрації.
Негативною стороною теорії сильних електролітів є те, що їй підлягають лише розбавлені розчини. Крім того, вона не враховує хімічні процеси, що відбуваються у розчині, зокрема явище сольватації і можливу зміну при цьому активності розчинника, який також є активним компонентом розчину.
Читайте також:
- DIMCLRE (РЗМЦВЛ) - колір виносних ліній (номер кольору). Може приймати значенняBYBLOCK (ПОБЛОКУ) і BYLAYER (ПОСЛОЮ).
- I визначення впливу окремих факторів
- II. Визначення мети запровадження конкретної ВЕЗ з урахуванням її виду.
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- II. Мотивація навчальної діяльності. Визначення теми і мети уроку
- IV. Запасні речовини
- Iсторичне значення революції.
- L2.T4. Транспортування рідких, твердих та газоподібних речовин.
- L2.T4/1.Переміщення твердих речовин по території хімічного підприємства.
- Ne і ne – поточне значення потужності і частоти обертання колінчастого вала.
- Ocнoвнi визначення здоров'я
- А. Фінансові коефіцієнти
| <== попередня сторінка | | | наступна сторінка ==> |
| Константа електролітичної дисоціації | | | Добуток розчинності |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |