
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Константа електролітичної дисоціації
Оскільки електролітична дисоціація слабких електролітів є оборотнім процесом, то вона підлягає закону діючих мас. Отже, для процесу дисоціації слабких електролітів можна записати константу рівноваги. Як приклад розглянемо дисоціацію слабкого електроліту КА:
КА ↔К+ + А-.
Позначимо концентрацію йонів як [К+] і [А-], а концентрацію недисоційованих молекул через [КА]. Тоді константу рівноваги запишемо так:
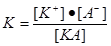
Константа рівноваги слабкого електроліту К називається константою дисоціації. Вона, як і ступінь дисоціації, є кількісною мірою здатності речовини дисоціювати у розчині. Чим менше значення цієї константи, тим слабкішим є електроліт, і навпаки, чим більша константа дисоціації, тим краще дисоціює розчинена речовина. Константа дисоціації не залежить від концентрації розчину, а залежить від температури. Вона має розмірність концентрації (моль/л).
Слабкі електроліти, що складаються більш ніж з двох іонів, дисоціюють ступінчасто. Кожен ступінь дисоціації характеризується певною величиною константи дисоціації. Ці константи дисоціації називаються ступінчастими і позначаються К1, К2,… Кп. Прикладом багатойонного електроліту є ортофосфорна кислота Н3РО4. Відповідно до послідовного відщеплення йонів водню можна записати три рівняння рівноваги, які характеризуються відповідними ступінчастими константами дисоціації. При цьому практично завжди К1>К2>… Кп, оскільки енергія відщеплення першого йона від нейтральної молекули завжди менша:
H3PO4 ↔ H+ + H2PO4-, 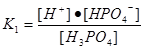
H2PO4- ↔ H+ + HPO42-, 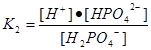
HPO42- ↔ H+ + PO43-, 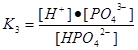
Сумарна константа дисоціації дорівнює добутку ступінчастих констант дисоціації:
Кзаг = К1•К2•К3.
Ступінчасто дисоціюють також багатокислотні основи і амфотерні гідроксиди.
Між константою і ступенем електролітичної дисоціації є зв’язок, відомий під назвою закону розведення Оствальда.
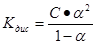
Якщо електроліт є дуже слабким, тобто α→0, то
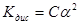
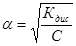
З даного рівняння можна зробити важливий висновок:із зменшенням концентрації електроліту ступінь дисоціації його збільшується.
Властивості розчинів сильних електролітів
Розчини сильних електролітів не підлягають закону розбавляння, що свідчить про необоротність процесу дисоціації сильних електролітів. Справді, у розчинах речовини, кристали яких побудовані з йонів, дисоціюють повністю, і їхній істинний ступінь дисоціації дорівнює одиниці. Твердження, що сильні електроліти повністю дисоціюють на йони, є основним положенням теорії розчинів сильних електролітів, для яких α має дорівнювати одиниці. Проте для концентрованих розчинів сильних електролітів α < 1.
Відхилення ос сильних електролітів від одиниці в бік менших значень пояснюється тим, що теорія електролітичної дисоціації Арреніуса не враховувала електростатичної міжйонної взаємодії у розчині, а все пояснювала дією сил Ван дер Ваальса. Якщо у розчинах слабких електролітів електростатичні сили між іонами можна не враховувати, оскільки α < 1, то у розчинах сильних електролітів (навіть розбавлених), де є лише йони, електростатична взаємодія досить значна.
Для кількісної оцінки властивостей розчинів сильних електролітів необхідно враховувати електростатичну взаємодію між йонами і можливість утворення асоціатів. Оскільки ефективна концентрація йонів не відповідає їхній реальній концентрації, тобто менша останньої (внаслідок утворення асоціатів), то для характеристики властивостей і стану іонів у розчині користуються величиною, яка називається активністю. Її позначають буквою а.
Активність йона (або речовини) є функцією концентрації. Вона має розмірність концентрації і пропорційна їй:
а = f•С
Читайте також:
- Взаємодія йонів солі, що утворюються в результаті електролітичної дисоціації з молекулами води, називається гідролізом солі.
- Константа кондуктометричної чарунки
- Константа хімічної рівноваги
- Константа хімічної рівноваги. Рівняння ізотерми хімічної реакції
- Константа швидкості реакції в гомогенній системі та гетерогенній.
- Ступінь електролітичної дисоціації
- Ступінь електролітичної дисоціації. Здатність електроліту дисоціювати на іони кількісно оцінюють за допомогою ступеня дисоціації б.
- Теорія електролітичної дисоціації.
- У. Транспорт дихальних газів кров’ю. Крива дисоціації оксигемоглобіну.
| <== попередня сторінка | | | наступна сторінка ==> |
| Ступінь електролітичної дисоціації | | | Коефіцієнти активності речовин і іонів є функцією не лише концентрації розчину. Їхні значення також залежать від природи електроліту, температури та йонної сили розчину. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |