
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Константа хімічної рівноваги. Рівняння ізотерми хімічної реакції
Усі хімічні реакції тією чи іншою мірою оборотні, тобто не проходять до кінця, до повного перетворення вихідних речовин у продукти. У реакційній суміші завжди відбуваються як пряма, так і зворотна реакції. У міру витрачання вихідних речовин швидкість прямої реакції зменшується; в міру накопичення продуктів зростає швидкість зворотної реакції. Коли ці швидкості зрівняються, встановиться динамічна рівновага: не буде відбуватися ні накопичення, ні витрачання вихідних речовин та продуктів. Сумарна швидкість прямої та зворотної реакцій буде дорівнювати нулю. Подібна рівновага називається хімічною рівновагою.
Умовою хімічної рівноваги є загальна умова термодинамічної рівноваги у системі – рівняння Гіббса-Дюгема:
å mі dni = 0.
Нехай у системі, що містить ідеальні гази А, В, D та F, проходить хімічна реакція
аА + вВ = dD + fF.
Тут а, в, d i f - стехіометричні коефіцієнти. Розраховуємо змінення енергії Гіббса цієї реакції. З урахуванням рівняння (5.6) одержуємо
DG=Gкон- Gисх=(GD + GF)–(GA+GB) = dmD+fmF-amA-bmB. (5,12)
Ураховуючи, що m = m0 + R×T×lnP, отримуємо
DG = dm0D + d×R×T× lnP¢D + fmF0 + f×R×T×lnP¢F - am0A –
- a×R×T× lnP¢A- bm0B - b×R×T× lnP¢B. (5,13)
У цьому співвідношенні P¢A, P¢B, P¢D i P¢F – парціальни тиски компонентів А, В, D i F у довільний момент часу (ці тиски у міру проходження реакції змінюються: зменшуються для речовин А і В і збільшуються для речовин D i F).
Очевидно, що алгебраїчна сума стандартних значень хімічних потенціалів є стандартним зміненням енергії Гіббса хімічної реакції DG0 і з урахуванням цього
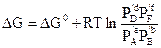 . (5,14)
. (5,14)
Якщо хімічна реакція досягла стану рівноваги, то енергія Гіббса реакції дорівнює нулю: DG = 0, тому
 . (5,15)
. (5,15)
Тут PA, PB, PD, PF уже не довільні парціальні тиски, а парціальні тиски речовин А, В, D, F у момент встановлення рівноваги, тобто постійні для даних умов величини. Отже, величина, що міститься під знаком логарифма, є величиною постійною. Вона позначається КР і називається константа хімічної рівноваги
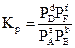 (5,16)
(5,16)
З урахуванням цього
DG0 = - R×T× lnKP. (5,17)
Остаточно, для енергії Гіббса даної хімічної реакції можна записати
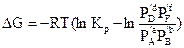 . (5,18)
. (5,18)
Отримане співвідношення називається рівнянням ізотерми хімічної реакції. За цим рівнянням можна розрахувати змінення енергії Гіббса для перетворення зазначених вище кількостей вихідних речовин у продукти при Р,Т = const. Якщо відома константа рівноваги хімічної реакції, легко оцінити знак виразу, що поданий у дужках у правій частині рівняння. Якщо перший член цього виразу більший від другого, то реакція буде проходити самодовільно зліва направо, оскільки для цього процесу D G < 0. У противному разі самодовільно буде проходити зворотна реакція.
Якщо хімічна реакція проходить в ідеальному розчині, тобто при V,T = const, то віддаленість реакції від рівноваги визначається величиною енергії Гельмгольца хімічної реакції DF, і шляхом аналогічних міркувань можна отримати такі співвідношення:
DF0 = - R×T×lnKc =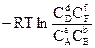 , (5,19)
, (5,19)
KC =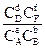 , (5,20)
, (5,20)
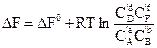 . (5,21)
. (5,21)
У цих рівняннях DF0 – стандартна енергія Гельмгольца хімічної реакції. КС – константа хімічної рівноваги, що виражена через рівноважні концентрації Cі речовин, C¢і – концентрації речовин у довільний момент часу. Останнє рівняння також має назву рівняння ізотерми хімічної реакції.
Константи КР і КС зв¢язані між собою простим співвідношенням. Оскільки Рі = Cі×R×T, то
 (5,22)
(5,22)
Із цього співвідношення випливає, що КР = КС, коли реакція проходить без змінення кількості молів у газовій фазі, тобто коли d+f = a+b.
Величина константи хімічної рівноваги дозволяє відповісти на питання про напрямок проходження хімічної реакції. Так, якщо константа рівноваги більша від одиниці, це означає відповідно до рівняння ізотерми реакції можливість самодовільного проходження реакції зліва направо. Якщо К < 1, то реакція буде проходити спонтанно у зворотному напрямку.
Читайте також:
- V Процес інтеріоризації забезпечують механізми ідентифікації, відчуження та порівняння.
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- Аварійне та довгострокове прогнозування хімічної обстановки
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антигени. Антитіла. Серологічні реакції .
- Асимптотичний підхід до порівняння оцінок
- Біогенні аміни та реакції декарбоксилювання
- Бюджетний контроль - це порівняння показників бюджету зі звітом за відповідний період часу.
- В обох випадках основним розрахунковим рівнянням є рівняння теплопередачі і теплового балансу
- Вивід основного рівняння фільтрації
| <== попередня сторінка | | | наступна сторінка ==> |
| Поняття про хімічний потенціал | | | Вплив зовнішніх умов на хімічну рівновагу |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |