
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Вплив зовнішніх умов на хімічну рівновагу
Зміни зовнішніх умов, за яких система перебуває у стані рівноваги, призводить до змінення параметрів системи, тобто до зрушення хімічної рівноваги. Для якісного визначення напрямку зрушення рівноваги у хімічній реакції використовують правило:
якщо система, що перебуває у стані рівноваги, зазнає впливу ззовні, тобто змінюються умови, за яких система перебувала у стані рівноваги, то в системі почнуть проходити процеси, що ослаблюють зовнішню дію.
Це правило називається принципом Ле Шательє-Брауна.Розглянемо вплив концентрації, температури та тиску на зрушення хімічної рівноваги.
Із виразу для константи рівноваги КС можна зробити висновок про те, що збільшення концентрації продуктів реакції ( D i F) призведе до збільшення швидкості зворотної реакції, тобто рівновага зрушиться у напрямку утворення вихідних речовин. Збільшення концентрацій вихідних речовин призведе до зміщення рівноваги у напрямку проходження прямої реакції.
При зміні загального тиску у рівноважній суміші парціальні тиски всіх учасників реакції змінюються в однакову кількість разів. Якщо у реакції кількість молів газів не змінюється, як, наприклад, у реакції Н2 + Cl2 = 2HCl, то склад суміші залишиться рівноважним, тобто рівновага не зміститься. Якщо кількість молів газів змінюється, то склад суміші у результаті змінення тиску стане нерівноважним, і буде проходити хімічна реакція. Напрямок зміщення рівноваги у цьому випадку залежить від того, збільшилася чи зменшилася кількість молекул газів. Розглянемо, наприклад реакцію
N2 + 3H2 = 2NH3.
Усі учасники цієї реакції гази. Нехай у рівноважній суміші збільшили загальний тиск (різко стиснули суміш). Рівновага порушилася, у системі повинні початися процеси, що призведуть до зменшення тиску. Але тиск пропорційний кількості ударів молекул об стінки, тобто кількості молекул. Із рівняння реакції випливає, що у результаті проходження прямої реакції кількість молекул газів зменшується, а в результаті зворотної – збільшується. Отже, зменшення загального тиску відбудеться, якщо рівновага зрушиться у напрямку проходження прямої реакції. При зменшенні загального тиску у рівноважній суміші рівновага у розглядуваній реакції зміститься у напрямку проходження зворотної реакції, що призводить до збільшення кількості газових молекул, тобто до збільшення тиску.
Для встановлення напрямку зміщення рівноваги при змінюванні температури скористаємося рівнянням Гіббса-Гельмгольца (див. лекцію 4)
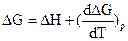
Підставимо у це рівняння рівняння ізотерми реакції
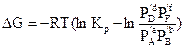
Враховуючи, що значення поточних тисків Р¢і від температури не залежать, отримуємо

Після скорочення отримуємо
 . (5.23)
. (5.23)
Отримане рівняння називається рівнянням ізобари хімічної реакції.Аналогічним шляхом отримуємо рівняння ізохори хімічної реакції:
 . (5.24)
. (5.24)
Рівняння ізобари та ізохори хімічної реакції дозволяє передбачати та оцінювати ( якісно та кількісно) залежність константи хімічної рівноваги від температури і напрямок зміщення рівноваги. Якщо D H > 0 (реакція ендотермічна), то dlnKP/dT>0. Це означає, що із підвищенням температури рівновага зміститься у бік прямої реакції і константа хімічної рівноваги збільшиться.
Якщо DH < 0 (екзотермічна реакція), то dlnKp/dT>0 і рівновага зрушується у бік зворотної реакції.
Взагалі при підвищенні температури рівновага зміщується у бік ендотермічної реакції, а при зниженні температури – у бік екзотермічної реакції. ЯкщоDH = 0, то рівновага при зміненні температури не зрушується. Наприклад, у системі
N2 + 3H2 = 2NH3, DH = - 92,4 кДж/моль
при підвищенні температури рівновага зміститься у бік зворотної (ендотермічної) реакції, а при зниженні температури – у бік прямої реакції.
Щоб визначити змінення константи хімічної рівноваги при зміні температури на кінцеву величину, треба проінтегрувати рівняння ізобари та ізохори хімічної реакції. За умови постійності DH і DU (це справедливо при невеликій зміні температури) отримуємо:
 i
i  . (5.25)
. (5.25)
Тут В і В¢ - константи інтегрування.
З цих рівнянь випливає, якщо тепловий ефект реакції не залежить від температури, то графік залежності, наприклад lnKP від 1/T, є прямою лінією (рис. 5.1). Якщо відомі константи хімічної рівноваги для декількох температур, то побудувавши графік lnKP = f(1/T), можна визначити константу інтегрування і тепловий ефект реакції.

Рисунок 5.1 – Залежність lnKP = f(1/T)
Читайте також:
- I визначення впливу окремих факторів
- Адаптація організму до зовнішніх факторів середовища.
- Аденогіпофіз, його гормони, механізм впливу
- Аденогіпофіз, його гормони, механізм впливу, прояви гіпер- та гіпофункцій.
- Адміністративні методи - це сукупність прийомів, впливів, заснованих на використанні об'єктивних організаційних відносин між людьми та загальноорганізаційних принципів управління.
- Активний вплив на проблему
- Аналіз відхилень від нормативів та їх впливу на прибуток
- Аналіз впливу постачальників
- Аналіз впливу факторів на зміну сумми гуртової реалізації
- Аналіз зовнішніх ризиків
- Аналіз факторів впливу на обсяги виробництва суспільного продукту.
- Аналіз факторів, що впливають на цінову політику.
| <== попередня сторінка | | | наступна сторінка ==> |
| Константа хімічної рівноваги. Рівняння ізотерми хімічної реакції | | | Хімічна рівновага у гетерогенних системах |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |