
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Хімічна рівновага у гетерогенних системах
Гетерогенними реакціями називаються реакції, у яких речовини, що реагують, є у двох або декількох фазах, що не утворюють між собою розчинів. При визначенні тиску системи, у якій відбувається гетерогенна реакція, крім тиску речовин, які є в газовій фазі, ураховують тиск парів рідких та твердих речовин.
Над рідкими та твердими фазами при постійній температурі завжди є насичена пара, тиск якої постійний і не залежить від кількості речовини, що міститься у рідкій або твердій фазі, оскільки у міру витрачання пари речовини із твердої або рідкої фази знову утворюється насичена пара однакового за величиною тиску.
Таким чином, при проходженні гетерогенної реакції у системі змінюються парціальні тиски лише тих речовин, які є у газоподібному стані.
Отже, при визначенні константи хімічної рівноваги гетерогенної реакції можна використати формули для констант рівноваги гетерогенних реакцій, не враховуючи множники, що належать до рідких або твердих фаз.
Розглянемо для прикладу реакцію розкладання карбонату кальцію
СаСО3(тв) = СаО(тв) + СО2(г)
та реакцію утворення оксиду вуглецю (ІІ)
С(тв) + СО2(г) = 2СО(г).
Запишемо для цих реакцій значення констант хімічної рівноваги, що виражені через парціальні тиски компонентів:
 і
і 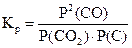 .
.
У цих співвідношеннях величини Р(СаСО3), Р(СаО) і Р(С), тобто парціальні тиски карбонату кальцію, оксиду кальцію та вуглецю при заданій температурі постійні. Тоді константи рівноваги для наведених гетерогенних реакцій відповідно дорівнюють
Кp = Р(СО2) і Кp = Р2(СО)/Р(СО2).
Усі інші співвідношення, отримані нами для описування хімічної рівноваги, справедливі і для гетерогенних реакцій.
Читайте також:
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Арифметичні операції в різних системах числення
- Баланс сил і рівновага в МС
- Біохімічна гіпотеза виникнення життя.
- Біохімічна ОБГРУНТУВАННЯ МЕТОДИКИ занять фізичною культурою і спортом з особами різного віку та статі
- Біохімічна характеристика тренованого організму
- В системах електропостачання.
- Взаємодія попиту і пропозиції та ринкова рівновага.
- Взаємодія попиту і пропозиції. Ринкова рівновага.
- Взаємодія попиту й пропозиції. Ринкова рівновага
- Взаємодія попиту та пропозиції. Ринкова рівновага
- Взаємодія попиту та пропозиції: ринкова рівновага.
| <== попередня сторінка | | | наступна сторінка ==> |
| Вплив зовнішніх умов на хімічну рівновагу | | | СТИСЛИЙ КОНСПЕКТ ЛЕКЦІЙ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |