
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
СТИСЛИЙ КОНСПЕКТ ЛЕКЦІЙ
Висновки
Введено поняття про хімічний потенціал, показано його зв'язок з концентрацією розчину або парціальним тиском компонента в газовій суміші. Виведено рівняння ізотерми, ізобари та ізохори хімічної реакції. Сформульовані умови хімічної рівноваги. Виведено вираз для константи хімічної рівноваги в гомогенних і гетерогенних системах. Розглянуто принцип Ле-Шательє - Брауна та його застосування до визначення зміщення хімічної рівноваги при зміні концентрації, тиску і температури.
На основі взаємозв¢язку між термодинамічними потенціалами і параметрами системи припускалося, що маса системи незмінна. Тоді для визначення стану системи достатньо було задати дві незалежні змінні величини (наприклад, Р і Т, V і S тощо). У хімічних реакціях склад системи змінюється, часто речовина переходить з одного агрегатного стану в інший. У цьому випадку до незалежних змінних як складова входить ще й склад суміші.
Термодинамічні потенціали кожної частини такої системи можуть бути подані функцією двох змінних та кількості молів усіх речовин, що входять до системи. Наприклад:
U = f(S,V,n1,n2…nk), G = f(P,T,n1,n2…nk).
Повний диференціал енергії Гіббса можна записати цьому випадку так:
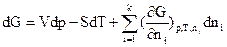
Частинна похідна енергії Гіббса за кількістю молів будь-якого(i) компонента при незмінній кількості молів усіх останніх компонентів(j) та при Р,Т = const називається хімічним потенціалом даного компонента

Якщо реакція проходить при постійних Р і Т, то
k
dG = å midni.
Після інтегрування отримуємо
Gi = mini,
тобто хімічний потенціал чистої речовини дорівнює енергії Гіббса одного моля цієї речовини.
Дуже часто хімічний потенціал подають у вигляді
m = m0(T) + R×T×lnP,
де m0(Т) – стандартний хімічний потенціал ідеального газу.
Хімічний потенціал можна також виразити через концентрації:
m = m10(T) + R×T×lnс.
Усі хімічні реакції тією чи іншою мірою оборотні, тобто не проходять до кінця, до повного перетворення вихідних речовин у продукти. У реакційній суміші завжди відбуваються як пряма, так і зворотна реакції. У міру витрачання вихідних речовин швидкість прямої реакції зменшується; в міру накопичення продуктів зростає швидкість зворотної реакції. Коли ці швидкості зрівняються, встановиться динамічна рівновага: не буде відбуватися ні накопичення, ні витрачання вихідних речовин та продуктів. Сумарна швидкість прямої та зворотної реакцій буде дорівнювати нулю. Подібна рівновага називається хімічною рівновагою.
Нехай у системі, що містить ідеальні гази А, В, D та F, проходить хімічна реакція
аА + вВ = dD + fF.
Тут а, в, d i f - стехіометричні коефіцієнти. Розраховуємо змінення енергії Гіббса цієї реакції:
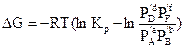
Отримане співвідношення називається рівнянням ізотерми хімічної реакції. У цьому співвідношенні P¢A, P¢B, P¢D i P¢F – парціальний тиск компонентів А, В, D i F у довільний момент часу.
Якщо хімічна реакція досягла стану рівноваги, то енергія Гіббса реакції дорівнює нулю: DG = 0, тому
 .
.
Тут PA, PB, PD, PF уже не довільні парціальні тиски, а парціальні тиски речовин А, В, D, F у момент встановлення рівноваги, тобто постійні для даних умов величини. Отже, величина, що міститься під знаком логарифма, є величиною постійною. Вона позначається КР і називається константою хімічної рівноваги
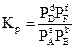
Якщо хімічна реакція проходить в ідеальному розчині, тобто при V,T = const, то віддаленість реакції від рівноваги визначається величиною енергії Гельмгольца хімічної реакції D F, і шляхом аналогічних міркувань можна отримати такі співвідношення:
DF0 = - R×T×lnKc =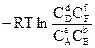 ,
,
KC =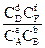 ,
,
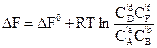 . (5,21)
. (5,21)
У цих рівняннях DF0 – стандартна енергія Гельмгольца хімічної реакції. КС – константа хімічної рівноваги, що виражена через рівноважні концентрації Cі речовин, C¢і – концентрації речовин у довільний момент часу. Останнє рівняння також має назву рівняння ізотерми хімічної реакції.
Зміни зовнішніх умов, за яких система перебуває у стані рівноваги, призводить до змінення параметрів системи, тобто до зрушення хімічної рівноваги. Для якісного визначення напрямку зрушення рівноваги у хімічній реакції використовують правило:
якщо система, що перебуває у стані рівноваги, зазнає впливу ззовні, тобто змінюються умови, за яких система перебувала у стані рівноваги, то в системі почнуть проходити процеси, що ослаблюють зовнішню дію.
Це правило називається принципом Ле Шательє-Брауна.
При зміні загального тиску у рівноважній суміші напрямок зміщення рівноваги залежить від того, збільшилася чи зменшилася кількість молекул газів. При зменшенні загального тиску у рівноважній суміші рівновага зміститься у напрямку проходження реакції, що приводить до збільшення кількості газових молекул, тобто до збільшення тиску. При збільшенні загального тиску - навпаки у напрямку проходження реакції, що приводить до зменшення кількості газових молекул, тобто до зменшення тиску.
Для встановлення напрямку зміщення рівноваги при змінюванні температури скористаємося рівнянням ізобари хімічної реакції:

Взагалі при підвищенні температури рівновага зміщується у бік ендотермічної реакції, а при зниженні температури – у бік екзотермічної реакції.
При проходженні гетерогенної реакції у системі змінюються парціальні тиски лише тих речовин, які є у газоподібному стані.
Отже, при визначенні константи рівноваги гетерогенної реакції можна використати формули для констант рівноваги гетерогенних реакцій, не враховуючи множники, що належать до рідких або твердих фаз.
Читайте також:
- Види лекцій
- Викладення лекційного матеріалу
- ГИСТОЛОГИЯ. КОНСПЕКТ ЛЕКЦИЙ.
- Електронний конспект лекцій
- Завдання лекційних занять
- І. ПРОСЛУХОВУВАННЯ ТА КОНСПЕКТУВАННЯ ЛЕКЦІЙ
- ІІ. МАТЕРІАЛИ ДО КУРСУ ЛЕКЦІЙ
- ІІI. Тематика лекцій
- ІІІ. ПЛАН ПРОВЕДЕННЯ ЛЕКЦІЙНОГО ЗАНЯТТЯ
- Індивідуальний метод обліку кількості знесених яєць проводять у селекційних стадах, застосовують для цього контрольні гнізда, або утримання в індивідуальних клітках.
- Коновалова М.Д.Экспериментальная психология: конспект лекций. - Высшее образование. – 2006.
- КОНСПЕКТ
| <== попередня сторінка | | | наступна сторінка ==> |
| Хімічна рівновага у гетерогенних системах | | | Конфлікт як соціально-психологічне явище |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |