
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Ступінь електролітичної дисоціації
Здатність електроліту дисоціювати на йони кількісно оцінюють за допомогою ступеня дисоціації а.
Ступінь дисоціації α — це відношення числа молів електроліту, що розпався на йони, до його загальної концентрації у розчині. Якщо позначити число молів продисоційованого електроліту через Сдис (моль/л), а загальну концентрацію — Сзаг (моль/л), то ступінь електролітичної дисоціації дорівнюватиме:
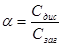
З цього виразу видно, що αзмінюватись від нуля до одиниці або у процентах від 0 до 100.
До сильних електролітів належать речовини, які в розчині дисоціюють практично повністю. Це більшість солей, сильні кислоти, гідроксиди лужних та лужноземельних металів, для них α>30%.
Слабкі електроліти у розчині дисоціюють частково, до них належать більшість слабких основ і кислот, а також органічні кислоти і основи (α<3%).
Характерною особливістю слабких електролітів є встановлення в розчині рівноваги між йонами і молекулами розчиненої речовини:
СН3СООН ↔ СН3СОО- + Н+
Із зменшенням концентрації розчину рівновага зміщується вправо, тобто дисоціація кислоти посилюється, а отже, збільшується ступінь електролітичної дисоціації.
Величина ступеня дисоціації електроліту крім хімічної природи речовини і концентрації розчину залежить і від природи розчинника. Так, розчин хлороводню у воді є сильним електролітом, а бензольний розчин НС1 практично не проводить електричний струм. Отже, поділ електролітів на сильні і слабкі є умовним і сила електроліту значною мірою залежить від природи розчинника і його діелектричної проникності. По суті електролітом є не сама розчинена речовина, а речовина і розчинники, які й утворюють електролітичний розчин, що проводить електричний струм.
Ступінь електролітичної дисоціації часто визначають експериментально за величиною ізотонічного коефіцієнта або вимірюванням електропровідності розчинів різних концентрацій.
Позначивши через С загальну концентрацію електроліту (моль/л), α —ступінь його дисоціації, а п — число іонів, на яке дисоціює молекула електроліту, дістанемо:
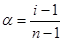
Для бінарних електролітів формула стає наступною (NaCl, KNO3):
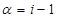
Для калію сульфату n=3, натрію ортофосфату n=4.
Читайте також:
- Біржова валютна торгівля та ступінь валютного регулювання і контролю
- Взаємодія йонів солі, що утворюються в результаті електролітичної дисоціації з молекулами води, називається гідролізом солі.
- Види, фактори і ступінь порушення типів місцевості.
- Визначати ступінь відповідності обраної регресії відображуваним на діаграмі даним.
- Високий ступінь майстерності публічного виступу, мистецьке володіння словом.
- Впевненість — це ступінь довіри користувача до достовірності предмета перевірки аудитором.
- Константа електролітичної дисоціації
- Найважливішою якісною характеристикою валюти є ступінь її конвертування.
- Найвищий ступінь порівняння
- Напрями та методи впливу на ступінь ризику господарювання
- Незначний ступінь залежності.
- П'ятий ступінь
| <== попередня сторінка | | | наступна сторінка ==> |
| ТЕМА: Теорія сильних та слабких електролітів. Рівновага в розчинах малорозчинних електролітів. Теорії кислот та основ. Дисоціація води. рН | | | Константа електролітичної дисоціації |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |