
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ТЕМА: Теорія сильних та слабких електролітів. Рівновага в розчинах малорозчинних електролітів. Теорії кислот та основ. Дисоціація води. рН
Актуальність теми полягає у формуванні в студентів знань по вимірюванню водневого показника різними методами і застосовування його на практиці. Знання основних положень електролітичної дисоціації необхідне в практичній роботі фармацевта, особливо при виготовленні та аналізі рідких лікарських форм (розчинів неорганічних кислот, основ і солей).вміння проводити розрахунки та володіти технікою приготування розчинів з заданою концентрацією необхідні майбутнім провізорам при роботі в умовах складу, аптеки, контрольно-аналітичної лабораторії та на підприємствах, які виготовляють лікарські форми.
Мета лекції полягає в ознайомленні студентів з теорією електролітичної дисоціації та властивостями розчинів сильних і слабких електролітів.
План лекції
Вступ
1. Властивості розчинів електролітів
2. Теорія електролітичної дисоціації
3. Ступінь електролітичної дисоціації
4. Константа електролітичної дисоціації
5. Властивості розчинів сильних електролітів
6. Добуток розчинності
7. Дисоціація води. Йонний добуток води. рН
8. Реакції у розчинах електролітів, йонні рівняння
Підготував: доцент Стецьків А.О.
Обговорено та затверджено на засіданні кафедри хімії
«29» квітня 2013 року
Протокол №9
Завідувач кафедри хімії доц. Стецьків А.О.
Властивості розчинів електролітів
У попередній лекції було показано, що колігативні властивості розчинів неелектролітів лінійно залежать від концентрації розчиненої речовини і не залежать від її хімічної природи. Навіть для неелектролітів лінійна залежність фізичних властивостей розчинів від концентрації спостерігається лише для досить розбавлених розчинів, в яких взаємодії між молекулами речовин і розчинника практично немає. Такі розчини називаються ідеальними. Відхилення від ідеального стану у розчинах неелектролітів зростає із збільшенням їхньої концентрації. Якщо замість розчинів неелектролітів (цукру, спиртів тощо) візьмемо розчини кислот, основ або солей такої самої концентрації, то для останніх спостерігаються істотні відхилення від законів Рауля і Вант-Гоффа. На противагу неелектролітам ці відхилення збільшуються із зменшенням концентрації розчину електролітів.
Експериментальні значення величин ∆p, π, ∆Tкип., ∆Tзам. для розчинів кислот, основ і солей більші за теоретично обчислені за відповідними законами Рауля і Вант-Гоффа. Тому для оцінки міри відхилення від ідеальних систем Вант-Гофф запропонував ввести так званий поправковий, або ізотон ічний коефіцієнт і, який є відношенням відповідних експериментальних значень величин цих величин до теоретично обчислених:
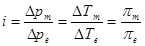
Це рівняння показує, у скільки разів експериментальні значення осмотичного тиску, зниження температури замерзання та інших величин більші за відповідні теоретично обчислені за рівняннями Рауля і Вант-Гоффа, якщо концентрації розчинів однакові. Експериментально доведено, що ізотонічний коефіцієнт і для розчинів кислот, основ і солей, як правило, більший за одиницю і залежить від концентрації розчину. Із зменшенням концентрації розчину він збільшується і наближається до цілих чисел 2, 3 і 4. Для найпростіших електролітів (KCl, КОН, НС1 та ін.) 2 > і > 1, для більш складних (K2SО4, MgCl2) 3 > і> 2.
Оскільки величини ∆p, π, ∆Tкип., ∆Tзам. є функцією числа частинок розчиненої речовини, то відхилення розчинів електролітів від законів, що описують поведінку розчинів неелектролітів, зумовлене збільшенням концентрації частинок у розчині електроліта. Крім того, при вивченні водних розчинів електролітів встановлено, що вони добре проводили електричний струм. Щоб пояснити ці факти, шведський фізикохімік С. Арреніус (1887 р.) запропонував гіпотезу, згідно з якою у розчині молекули речовин-електролітів розпадаються на іони не під дією електричного струму, а в процесі розчинення. Завдяки систематичному дослідженню розчинів електролітів (С. Арреніус, Я. Г. Вант-Гофф, В. Оствальд) на основі цієї гіпотези було створено теорію електролітичної дисоціації.
Теорія електролітичної дисоціації
В основі теорії електролітичної дисоціації лежать два припущення: 1) розчинення електроліту супроводиться розкладом йогомолекул на йони; 2) електролітична дисоціація є оборотнім процесом.
Внаслідок утворення йонів розчини багатьох речовин, які називаються електролітами(солі, кислоти, основи), проводять електричний струм. Те саме можна сказати і про розплави солей (наприклад, KCl, NaCl, СаС12), основ (КОН, NaOH) і деяких кислот. При дисоціації утворюються позитивно і негативно заряджені йони, які відповідно називають катіонами і аніонами. Наявність у розчині іонів, які безперервно рухаються, зумовлює електропровідність розчинів електролітів.
Основоположники теорії електролітичної дисоціації стверджували, що розчинена речовина і розчинник не взаємодіють. При цьому розчинник розглядався як індиферентне середовище, а процес розкладу молекул електроліту на йони — як фізичний процес.
Д.І.Менделєєв не визнавав гіпотезу Арреніуса про розпад молекул речовин на йони, вважаючи підхід С. Арреніуса до поняття розчину спрощеним і суто фізичним. Однак гідратна (хімічна) теорія розчинів Менделєєва, яка стверджувала, що розчинена речовина обов’язково вступає у хімічну взаємодію з молекулами розчинника, дала змогу російському фізикохіміку І.О.Каблукову об’єднати фізичну і хімічну теорії розчинів (1891 р.).
За О.І.Каблуковим, йони утворюють з водою нестійкі сполуки — гідратовані йони. Отже, з одного боку, при розчиненні електролітів розщеплюються їхні молекули на йони, а з другого— йони взаємодіють з молекулами води (розчинника). При цьому обидва процеси — дисоціація і гідратація (або сольватація) — відбуваються одночасно.
У розчині іони оточені певною кількістю дипольних молекул розчинника, які разом з іонами беруть участь у тепловому русі як єдина система.
Читайте також:
- E) теорія раціонального вибору.
- I. Теорія граничної продуктивності і попит на ресурси
- V теорія граничної корисності визначає вартість товарів ступенем корисності останньої одиниці товару для споживача.
- А .Маршалл - основоположник неокласичної теорії.
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Аксіоматичний метод у математиці та суть аксіоматичної побудови теорії.
- Альдегід Реактив Толенса Кислота
- Альтернативні теорії вартості
- Альтернативні теорії капіталу
- Альтернативні теорії макроекономічного регулювання
- Альтернативні теорії максимізації
- Альтернативні уявлення щодо макроекономічного регулювання: теорії раціональних сподівань та економіка пропозиції. Крива Лафера.
| <== попередня сторінка | | | наступна сторінка ==> |
| ЛЕКЦІЯ №8 | | | Ступінь електролітичної дисоціації |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |