
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Тема. Основні поняття хімії.
Лекція 1
Мета лекції:
Ознайомлення з основними поняттями хімії: хімічний елемент, атом, молекула, іони електрони, відносна атомна маса, відносна молекулярна маса, моль, молярний об’єм.
Матеріал лекції сприяє формуванню наступних компетенцій: загально-наукові компетентності КЗН-4 (Базові знання фундаментальних наук в обсязі, необхідному для освоєння загально-професійних дисциплін); Інструментальні компетентності КІ-5 (Усне і письмове спілкування рідною мовою); Системні компетентності (застосувати свої знання на практиці) КС-1
В процесі вивчення основних понять хімії курсант повинен отримати:
Знання, про:
- Будову атома;
- які іони утворюються при приєднанні і віддачі електронів;
- що таке хімічна реакція;
- що таке термохімічні рівняння;
- що характеризує порядковий номер елемента;
- знає визначення відносної атомної маси елемента;
- визначення відносної молекулярної маси речовини;
- визначення моль;
- визначення молярної маси , молярного об’єму газів;
- що таке ендо і екзотермічні реакції.
План лекції:
- Визначення хімії як науки;
- Поняття хімічний елемент, відносна атомна, відносна молекулярна маса;
- Моль, молярна маса, молярний об’єм;
- Поняття про еквівалент;
- Типи хімічних реакцій;
- Екзо і ендотермічні рівняння;
- Хімічні сполуки і суміші.
Хімія – це наука, яка вивчає склад, будову, властивості та перетворення речовин.
Неможливо уявити собі жодну галузь, де б не використовувалися поняття та закони хімії.
Сьогодні ми з вами і повторимо основні поняття і закони хімії.
Вперше визначення хімії як науки дав М.В.Ломоносов. І саме він вперше запропонував використовувати в хімії атомно-молекулярне вчення. В подальшому положення, висловлені Ломоносовим, неодноразово повторювалися і доповнювалися, і лише в 19 столітті АМУ затвердилося безперечно. Були прийняті поняття молекула та атом.
Атом – найменша хімічно неподільна електронейтральна частинка матерії, що складається з позитивно зарядженого ядра й негативно заряджених електронів і є носієм хімічних властивостей елемента.
Молекула – найменша частинка речовини, яка має сталий склад і зберігає її хімічні властивості.
З точки зору АМУ кожен окремий вид атомів називається хімічним елементом.
Ознакою, яка відрізняє один атом від іншого, є заряд ядра атома. Саме тому більш повне визначення хімічного елементу буде таке:
Хімічний елемент – це різновид атомів з однаковим протонним числом (заряд ядра атома).
Маси атомів надзвичайно малі, і використовувати ці числа при розрахунках дуже незручно. Тому використовують відносні значення мас атомів. За одиницю відносної атомної маси прийнята а.о.м, яка дорівнює 1/12 частини маси атома ізотопу Карбону 12С.
Відносна атомна (молекулярна) маса Ar (Mr) – значення маси атома (молекули), виражене в атомних одиницях маси. 1 атомна одиниця маси /а.о.м./ дорівнює 1/12 частини маси атома ізотопу Карбону 12С і становить 1,66 · 10–24 г.
Відносна атомна маса показує, в скільки разів маса атома даного елементу більше за 1/12 частини маси атома ізотопу Карбону 12С.
Значення Ar наводяться в періодичній системі Д.І. Мендєлєєва.
Чому в періодичній системі наводяться дробні вирази відносних атомних мас?
Ізотопи – це різновид атомів з одноковим протонним числом, але різною відносною атомною масою.
наприклад:
Ar (Х) = Σ (0р1 + 0n1)
8O16 8O17 8O18
Ізотопи всіх елементів не відрізняються між собою за властивостями. Винятком є ізотопи Гідрогену: 1Н1 1Д2 1Т3
Властивості елементів, утворених цими сполуками, відрізняються між собою. Наприклад, проста вода має температуру замерзання 0 оС, важка вода (з дейтерієм) - –3 оС, відповідно температури кипіння цих сполук складають 100 оС та 103 оС.
Молекулярна маса конкретної речовини дорівнює сумі відносних атомних мас атомів усіх елементів, що входять до складу молекули, з урахуванням їх індексів.
Мr (Н2О)=2Ar (Н) + Ar(О)
Моль – це одиниця кількості речовини (входять до системи СІ) – це така кількість речовини, що містить 6,02 · 1023 структурних одиниць (атомів, молекул, йонів, електронів і т. ін.).
Число 6,02 · 1023 називають сталою Авогадро.
Na=6,02 · 1023 моль –1
Маса 1 моль даної речовини називається її молярною масою. Вона вимірюється в г/моль і позначається буквою «М». Молярну масу знаходять, як відношення маси речовини до її кількості:
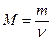 , г/моль.
, г/моль.
Молярна маса дорівнює чисельно відносній молекулярній масі речовини.
Наприклад, молярна маса сульфатної кислоти М(Н2SO4) = 98 г/моль.
Об’єм 1 моль газоподібної речовини називається молярним об’ємом.
Хімічні елементи взаємодіють один з одним в певних співвідношеннях. Наприклад, один моль атомів Гідрогену (1,0079 г) може взаємодіяти лише з одним молем атомів Хлору (35,453 г). ці масові кількості рівноцінні або еквівалентні між собою.
Еквівалент (Е) – масова кількість речовини, що взаємодіє з одним атомом чи йоном Гідрогену чи заміщає таку його кількість у хімічних реакціях. Еквівалент речовини залежить від того, в якій конкретно реакції бере участь ця речовина.
Масу 1 моль еквівалентів речовини називають молярною масою еквівалентів речовини (М1/z).
NaOH + H2SO4 → NaHSO4 + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
Молярні маси еквівалентів простих речовинрозраховують за формулою:
М1/z =  , (г/моль), де В – валентність елемента за формулою.
, (г/моль), де В – валентність елемента за формулою.
Наприклад: М1/z (Н2) = 1 г/моль, М1/z (О2) = 8 г/моль.
Читайте також:
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- II. Основні засоби
- II. Поняття соціального процесу.
- II.3. Основні способи і прийоми досягнення адекватності
- V. Поняття та ознаки (характеристики) злочинності
- VII. ОСНОВНІ ЕТАПИ РОЗВИТКУ УКРАЇНСЬКОЇ КУЛЬТУРИ У ХХ ст.
- А/. Поняття про судовий процес.
- Агроценоз як система.
- Адвокатура в Україні: основні завдання і функції
- Адміністративний проступок: поняття, ознаки, види.
- Адміністративні правовідносини: поняття, ознаки,
- Адміністративні провадження: поняття, класифікація, стадії
| <== попередня сторінка | | | наступна сторінка ==> |
| Что наблюдается? | | | Молярні маси еквівалентів складних речовин. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |