
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Розчин кипить при температурі вищий, ніж чистий розчинник. Із збільшенням концентрації розчину температура кипіння підвищується.
Підвищення температури кипіння прямо пропорційне його моляльності m:
ΔТкип = Ккип ∙ m (2.4)
Коефіцієнт Ккип - ебуліоскопічна стала(віл лат. “ебуліо” – кипіти). Ебуліоскопічна стала залежить тільки від природи розчинника і не залежить від природи розчиненої речовини.
Одномоляльний розчин будь-якого неелектроліта у воді при нормальному атмосферному тиску буде кипіти при 100,513оС, тобто ебуліоскопічна стала воли Ккип. н2О = 0,513о.
Ебуліоскопічна стала розчинника або молярне підвищення температури кипіння чисельно дорівнює ΔТкип при моляльній концентрації 1моль/кг, якщо розчин при цій концентрації має властивості ідеального.
Метод дослідження властивостей розчинів, який базується на визначенні температури їх кипіння, називається ебуліоскопією.
Константи Ккип і Кзам постійні для кожного розчинника і не залежать від природи розчиненої речовини (табл.1.6)
На зміні пониження температури замерзання або підвищення температури кипіння оснований один з методів визначення відносної молекулярної маси. Рівняння (2.3) і (2.4) можна записати в загальному вигляді:
ΔТ = К m
Моляльність розчину розраховують за формулою:
m = 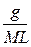
 . 1000,
. 1000,
де g- маса розчиненої речовини, г;
L - маса розчинника, г;
M – молярна маса розчиненої речовини.
Тоді об’єднавши цих два рівняння, матимемо:
ΔТ = 
 . 1000 або М =
. 1000 або М = 
 . 1000 (2.5)
. 1000 (2.5)
Таким чином, за рівнянням (2.5) можна розраховувати молярну масу розчиненої речовини, якщо відомо пониження температури замерзання або підвищення температури кипіння розчину певної концентрації.
На зниженні температури замерзання рідин при розчиненні в них нелетких речовин ґрунтується дія антифризів.
Антифризи – речовини, додавання яких знижує температуру замерзання розчину.
Завдяки тому, що температура замерзання розчинів нижча, ніж температура замерзання ідеальних рідин, розчини використовують як хладоносії – рідини, які охолоджують до низьких температур і подають по трубам до місця споживання холоду.
Для цієї мети використовують розчини NaCl, CaCl2, етиленгліколю, але вони викликають корозію труб. Тому найкраще використовувати водні розчини пропиленгліколю, їх температура замерзання нижча –50оС і вони не виявляють корозійної активності.
Такі біологічні рідини, як молоко і кров, які є багатокомпонентними розчинами, замерзають при температурі нижче 0оС. Температура
замерзання нормального коров’ячого молока знаходиться в межах від (-0,54) до (-0,58)оС. Відхилення від цієї температури вказує на розведення молока водою.
Таблиця 1.6
Читайте також:
- THERMA-thin – аналог THERMA-СHEK, не загущує буровий розчин.
- Y. Температура тіла та її регуляція.
- Абразивність гірських порід і геостатична температура
- Агрегативна стійкість і коагуляція колоїдних розчинів
- АДСОРБЦІЯ З БАГАТОКОМПОНЕНТНИХ РОЗЧИНІВ
- АДСОРБЦІЯ НА МЕЖІ РОЗЧИН – ГАЗ
- Адсорбція на межі розчин – газ.
- Адсорбція на межі тверде тіло – розчин.
- Азбестосолегелевий розчин
- Аналіз розчину з осадом
- Антисептики ароматичного ряду (фенол чистий, іхтіол, дьоготь, мазь Вількінсона, лінімент за Вишневським). Особливості протимікробної дії та застосування.
- Барвники і барвні розчини. Приготування
| <== попередня сторінка | | | наступна сторінка ==> |
| ТЕМПЕРАТУРА КРИСТАЛІЗАЦІЇ І КИПІННЯ РОЗЧИНІВ | | | Кріоскопічні і ебуліоскопічні сталі для деяких розчинників |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |