
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ТЕМПЕРАТУРА КРИСТАЛІЗАЦІЇ І КИПІННЯ РОЗЧИНІВ
На відміну від чистої рідини розчин при охолодженні не замерзає повністю при постійній температурі. При певній температурі з розчину починають виділятися кристали розчинника і, по мірі охолодження, кількість їх зростає до тих пір, поки весь розчин за кристалізується.
Температурою кристалізації (замерзання) розчину вважають температуру, при якій починається утворення кристалів.
Замерзає рідина при тій температурі, при якій тиск пари речовини в твердому стані стає рівним тиску пари цієї ж речовини в рідкому стані. Наприклад, тиск пари льоду і тиск пари води однаковий і дорівнює 46мм рт.ст. при 00С, тому 00С вважається температурою замерзання води. Якщо ж взяти розчин якої-небудь речовини у воді, то в зв’язку з пониженням тиску пари при 00С він буде мати менший тиск пари, ніж чиста вода. Так, наприклад, розчин, що містить 10г солі NaCl в 100г води, замерзає при температурі -13,60С, морська вода замерзає при температурі -2,50С і т.д.
При кристалізації розчинів кристали розчинника знаходяться в рівновазі з розчином і тиск пари над кристалами розчинника, і тиск пари над розчином повинен бути однаковим.
На рис. 10 представлена фазова діаграма води, яка доповнена кривою ВЕ, що характеризує тиск пари води над розчином нелеткої речовини. Ця крива розташовується нижче кривої СD – кривої тиску насиченої пари чистої води.
В точці B тиск пари льоду дорівнює тиску пари над розчином. Температура, що відповідає цій точці, буде температурою замерзання розчину (Тзам.).
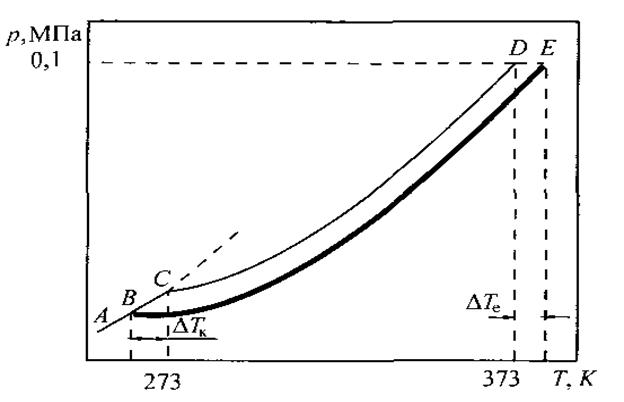
Розчин замерзає при більш низьких температурах, ніж чистий розчинник. Із збільшенням концентрації розчину температура замерзання знижується.
Рис.10. Залежність пружності насиченої пари води від температури над льодом (крива АС), водою (крива СД) і водним розчином (крива ВЕ)
Вивчаючи замерзання і кипіння розчинів, Рауль встановив:
Підвищення температури кипіння і зниження температури замерзання розведених розчинів неелектролітів пропорційне моляльній концентрації розчину.
ΔТзам = Кзам∙m (2.3)
де m - моляльна концентрація розчину, моль/кг;
Кзам - кріоскопічна стала.
Якщо прийняти m = 1, то Тзам=Кзам. Отже, коефіцієнт Кзам дорівнює зниженню температури замерзання розчину, в якому на 1 моль розчиненої речовини приходиться 1кг розчинника. Для кожного розчинника цей коефіцієнт постійний і не залежить від природи розчиненої речовини. Її називають кріоскопічною сталою (від грецьк. “кріос” – холод). Кріоскопічна стала води Кз Н2О = 1,86.
Кріоскопічна стала розчинника або молярне зниження температури замерзання чисельно дорівнює зниженню температури замерзання в одномоляльному розчині з властивостями ідеального.
Метод вивчення властивостей розчинів, який базується на вимірюванні температури їх замерзання, був розроблений Бекманом і одержав назву кріоскопії.
Читайте також:
- Y. Температура тіла та її регуляція.
- Абразивність гірських порід і геостатична температура
- Агрегативна стійкість і коагуляція колоїдних розчинів
- АДСОРБЦІЯ З БАГАТОКОМПОНЕНТНИХ РОЗЧИНІВ
- В однакових об'ємах різних газів за однакових умов (температура і тиск) міститься однакова кількість молекул.
- Види робочих розчинів
- Визначення нормальності робочих титрованих розчинів
- Властивості будівельних розчинів
- ВЛАСТИВОСТІ РОЗЧИНІВ НЕЕЛЕКТРОЛІТІВ
- Властивості розчинів сильних електролітів
- Густина і температура плавлення деяких металів
- Давление насыщенного водяного пара при различных температурах
| <== попередня сторінка | | | наступна сторінка ==> |
| Відносне зниження тиску насиченої пари розчинника над розчином дорівнює молярній частці розчиненої речовини. | | | Розчин кипить при температурі вищий, ніж чистий розчинник. Із збільшенням концентрації розчину температура кипіння підвищується. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |