
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Властивості розчинів сильних електролітів
Розчини сильних електролітів не підпорядковуються закону розведення, що свідчить про необоротність процесу дисоціації сильних електролітів. На-справді речовини, кристали яких побудовані з іонів, у розчинах дисоціюють повністю − їх дійсний ступінь дисоціації дорівнює одиниці. Твердження, що сильні електроліти повністю дисоціюють на іони, є основним положенням теорії розчинів сильних електролітів, для яких a повинно дорівнювати одиниці. Однак для концентрованих розчинів сильних електролітів a < 1. Тому експериментальне значення a сильних електролітів називають уявним ступенем дисоціації.
Відхилення α сильних електролітів від одинці в бік менших значень пояснюється тим, що в теорії електролітичної дисоціації Арреніуса не була врахована електростатична міжіонна взаємодія в розчині, а пояснювалося все дією сил Ван-дер-Ваальса. Якщо в розчинах слабких електролітів електростатичні сили між іонами можна не брати до уваги, оскільки α<<1, то в розчинах сильних електролітів не враховувати їх не можна,і тому вводиться коефіцієнт активності.
Коефіцієнт активностіречовин та іонів характеризує ступінь відхилення властивостей реального розчину від властивостей ідеального, де немає жодної взаємодії. Він є функцією концентрації розчину, природи електроліту, температури та іонної сили розчину.
Можна сказати, щоактивність – це уявна концентрація. Ця величина позначається літерою a та розраховується за формулою
a=f∙C ,
де f - коефіцієнт активності, C – молярна концентрація речовини.
Іонна сила розчину (m) − це півсума добутку концентрації всіх іонів
у розчині та квадрата їх заряду z:
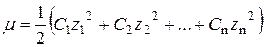 .
.
Вважають, що в разі постійного значення іонної сили розчину коефіцієнти активності іонів також залишаються сталими і не залежать від їх концентрації.
Оскільки не існує прямих методів визначення коефіцієнтів активності, то їх значення можна знайти шляхом розрахунку. Зокрема, для їх обчислення можна застосовувати формулу Дебая−Хюккеля:
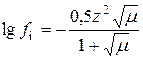 ,
,
якщо  , то
, то  .
.
Недоліком теорії сильних електролітів є те, що їй підпорядковуються тільки розбавлені розчини. Крім того, вона не враховує хімічні процеси, які відбуваються в розчині, зокрема явище сольватації і можливі зміни внаслідок цього в активності розчинника, який теж є активним компонентом розчину.
Читайте також:
- OПТИЧНІ ВЛАСТИВОСТІ КОЛОЇДНИХ СИСТЕМ
- А) Товар і його властивості.
- Агрегативна стійкість і коагуляція колоїдних розчинів
- Адсорбція електролітів
- Адсорбція електролітів
- АДСОРБЦІЯ З БАГАТОКОМПОНЕНТНИХ РОЗЧИНІВ
- Аеродинамічні властивості колісної машини
- Алкани (насичені вуглеводні). Хімічні властивості алканів
- Алкани, їх хімічні властивості.
- Алкени. Хімічні властивості
- Алкіни. Хімічні властивості
- Аміни. Фізичні та хімічні властивості аліфатичних амінів.
| <== попередня сторінка | | | наступна сторінка ==> |
| Константа електролітичної дисоціації | | | Добуток розчинності |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |