
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ЕЛЕКТРОХІМІЧНІ ЕЛЕМЕНТИ
Електрохімічним елементом називається прилад, в якому енергія хімічних реакцій, що протікають на електродах, перетворюється в електричну енергію.
Назві «електрохімічний елемент» відповідає назва «гальванічний елемент», яка складалася історично.
Дія гальванічний елементів як джерела напруги заснована на хімічній природі електродів та електролітів. Вони називаються первинними джерелами струму, на відміну від акумуляторів – вторинних джерел струму, які потребують періодичної зарядки від інших джерел струму.
Розрізняють три типи гальванічних елементів: хімічні, концентраційні та окисно-відновні. Проте процеси, які відбуваються в цих гальванічних елементах, цілком аналогічні. На одному з електродів проходить окиснення, в результаті чого на ньому накопичуються електрони і він заряджається негативно, а на другому електроді йде реакція відновлення і цей електрод заряджається позитивно. Хімічний елемент складається з двох різних за природою, а концентраційний – з двох однакових електродів, занурених у розчини різних концентрацій. Окисно-відновними елементами називають прилади, в яких обидва або хоча б один з електродів є окисно-відновним.
При схематичному записі гальванічних елементів дотримуються таких правил: спочатку вказують хімічний символ або назву електрода, потім – хімічний символ або назву розчину електроліту, який контактує з електродом, далі – розчин, в який занурений другий електрод, і, нарешті, вказують хімічний символ або назву другого електрода. Межі поділу фаз електрод-розчин позначають вертикальними рисками, межі між двома розчинами – двома вертикальними рисками. Полярність електродів вказують на початку і в кінці рядка в дужках:
(-) Zn | ZnSO4 || CuSO4| Cu (+).
Якщо електрод або розчин містять декілька речовин, їх хімічні символи розділяють комами:
(-) Pt, H2| H2SO4|| CuSO4, H2SO4 | Cu (+).
Першим (зліва) записують електрод, який при роботі гальванічного елемента заряджається негативно. Цей електрод називають анодом. Другий електрод – катод, що під час роботи заряджається позитивно, в схематичному записі гальванічного ланцюга записують справа.
J Тест по темі “Електрохімія”
| Питання | Варіанти відповіді |
| 1. В процесах електролізу… | а) електрична енергія перетворюється в хімічну; б) хімічна енергія перетворюється в електричну; в) перетворень енергії не відбувається. |
| 2. Одиницями еквівалентної електропровідності є… | а)  ; б) ; б) 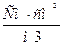 ; в) ; в) 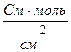 ; г) ; г) 
|
| 3. У розчині електролітів носіями струму є… | а) електрони; б) іони; в) електрони та іони. |
| 4. Електропровідність - це величина, яка… | а) прямо пропорційна опору; б) не залежить від опору; в) обернена до опору. |
| 5. Закон Кольрауша: | а) 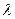 0 = Lа - Lк ; б) 0 = Lа - Lк ; б) 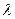 0 = Lk - Lа; в) 0 = Lk - Lа; в) 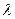 0 = Lа+ Lк 0 = Lа+ Lк
|
| 6. Питома електропровідність розчинів… | а) зменшується із зменшенням концентрації електроліту; б) зменшується із збільшенням концентрації електроліта; в) зростає із зменшенням концентрації; г) зростає із збільшенням концентрації електроліту. |
| 7. Рухливість іонів залежить від… | а) розмірів і степені гідратації іонів; б) розмірів іонів ,але не залежить від степені гідратації іонів; в) степені гідратації іонів і не залежить від розмірів іонів. |
| 8. В процесах виникнення електрорушійної сили… | а) електрична енергія перетворюється в хімічну; б) хімічна енергія перетворюється в електричну ; в) перетворень енергії не відбувається. |
| 9. Питома електропровідність вимірюється в одиницях: | а) См/см; б)1/Ом∙см; в) Ом/см; г) см/Ом; д) См/Ом∙см. |
| 10. Для температури 298 К рівняння Нернста при переході від натурального логорифма до десяткового приймає вигляд: | а) Е = Ео - 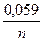 lg m;
б) Е = Ео + lg m;
б) Е = Ео + 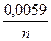 lg m;
в) Е = Ео - lg m;
в) Е = Ео -  lg m;
г) Е = Ео + lg m;
г) Е = Ео +  lg m lg m
|
| 11. Ряд стандартних електродних потенціалів утворюється при розташуванні… | а) неметалів в порядку зростання значень їх стандартних потенціалів; б) неметалів в порядку зменшення значень їх стандартних потенціалів; в) металів в порядку зростання значень їх стандартних потенціалів; г) металів в порядку зменшення значень їх стандартних потенціалів. |
| 12. Електрохімія - це розділ фізичної хімії, в якому вивчаються закономірності взаємних перетворень… | а) фізичної та хімічної форм енергії, б) фізичної та електричної форм енергії; в) хімічної та електричної форм енергії. |
´ КОНТРОЛЬНІ ЗАПИТАННЯ:
1. Що вивчає електрохімія?
2. Наведіть приклади сильних електролітів.
3. Дайте визначення еквівалентної електропровідності.
4. Що таке питома електропровідність? В яких одиницях її вимірюють?
5. Як пов’язані між собою еквівалентна і питома електропровідності?
6. Що таке молярна електропровідність при нескінченному розбавленні?
7. Як трактується закон незалежного руху іонів (Кольрауша)?
8. Наведіть рівняння Кольрауша.
9. Які два іони мають найбільшу рухомість?
10. Яка причина виникнення потенціалу на межі «метал-розчин»?
11. Що таке стандартний електродний потенціал?
12. Поясніть, як на поверхні електрода виникає подвійний електричний шар?
13. Що таке електродний потенціал? Від чого залежить значення електродного потенціалу?
14. Виведіть рівняння Нернста для розрахунку електродного потенціалу і проаналізуйте його.
15. Як класифікують електроди?
16. Які ви знаєте напрями застосування електрохімії?
17. Еквівалентна електрична провідність для нескінченних розведених водних розчинів СН3СООН і NaCl при 25оС становить відповідно 38,71 10-3 і 12,64 10-3 м2/Ом екв, хоча кислота – слабкий, а сіль – сильний електроліт. У чому причина такої великої різниці у величинах?
18. Творче завдання: Підготовити інформацію про вчених-хіміків, які стали лауреатами Нобелівської премії та за які досягнення.
Читайте також:
- II. Елементи операційних витрат
- Аграрна структура та її елементи
- Адміністративне правопорушення як підстава юридичної відповідальності: ознаки і елементи
- Адміністративне правопорушення як підстава юридичної відповідальності: ознаки і елементи.
- Азот, фосфор, біогенні елементи та їх сполуки, органічні речовини
- АКУСТИКА. ЕЛЕМЕНТИ ФІЗИКИ СЛУХУ. ОСНОВИ АУДІОМЕТРІЇ
- Базові елементи управління проектом
- Біоелементи.
- Будова й основні елементи машини
- Валідація НАССР- отримання об'єктивного доказу того, що елементи НАССР-плану результативні.
- Валютна система та її елементи
- Види валютних систем та їх елементи
| <== попередня сторінка | | | наступна сторінка ==> |
| Розрахуйте рН за даними таблиці (концентрація кислоти і солі однакові) | | | ТЕМА 1.4. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |