
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Стислі теоретичні відомості
Шар рідини, що прилягає до її поверхні та має товщину,сумірну з відстанню, на якій діють міжмолекулярні сили, називається поверхневим шаром. Молекули рідини в поверхневому шарі перебувають під дією сил притягання сусідніх молекул. Рівнодіюча цих сил притягання спрямована углиб рідини. Тому переміщення молекул з глибини рідини в поверхневий шар вимагає виконання системою роботи проти сил притягання.
Робота, яку необхідно виконати для збільшення площі поверхні рідини на одиницю, називається поверхневим натягом 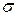 . Поверхневий натягможна розглядати також як силу, що діє на одиницю довжини контуру, який обмежує поверхню та обумовлює її скорочення. Відповідно до наведених визначень поверхневий натяг має розмірність Дж/м2 або Н/м.
. Поверхневий натягможна розглядати також як силу, що діє на одиницю довжини контуру, який обмежує поверхню та обумовлює її скорочення. Відповідно до наведених визначень поверхневий натяг має розмірність Дж/м2 або Н/м.
Робота утворення нової поверхні, яку система виконує внаслідок перебігу ізотермічного оборотного процесу (максимальна робота), чисельно дорівнює зменшенню енергії Гіббса (ізобарно-ізотермічного потенціалу) системи:
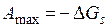 ,
,
а для одиниці площі поверхні 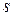 вона складає
вона складає
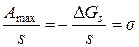 .
.
Таким чином, поверхневий натяг дорівнює надлишку енергії Гіббса, що припадає на одиницю площі поверхні.
Надлишок поверхневої енергії гетерогенної системи з міжфазною поверхнею поділу площею 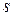 обчислюється за рівнянням
обчислюється за рівнянням
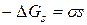 .
.
Самочинне прагнення до зменшення поверхневої енергії системи може бути реалізоване або шляхом зменшення міжфазної поверхні (наприклад, при коагуляції), або за рахунок зменшення поверхневого натягу розчину. Речовини, які, концентруючись на поверхні поділу фаз, здатні зменшувати її поверхневий натяг, називаються поверхнево-активними речовинами (ПАР).
Зв’язок між адсорбційними та енергетичними характеристиками поверхневого шару встановлює рівняння Гіббса
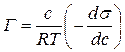 , ,
| (2.1) |
де Г – надлишкова адсорбція (поверхневий надлишок) розчиненої речовини (моль/м2), тобто надлишкова концентрація розчиненої речовини в поверхневому шарі розчину порівняно з його об’ємною концентрацією с; s – поверхневий натяг розчину, Дж/м2; R – універсальна газова стала; T – температура, К.
Величина 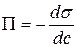 називається поверхневою активністю розчиненої речовини та характеризує її здатність до адсорбції. Якщо зі збільшенням концентрації розчиненої речовини у розчині поверхневий натяг зменшується, тобто
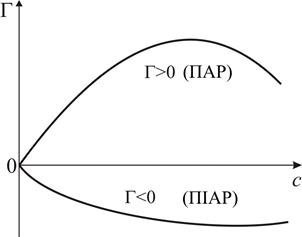
називається поверхневою активністю розчиненої речовини та характеризує її здатність до адсорбції. Якщо зі збільшенням концентрації розчиненої речовини у розчині поверхневий натяг зменшується, тобто 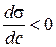 (рис. 4), згідно з рівнянням (2.1) Г > 0 (рис. 5), адсорбція позитивна і ПАР накопичується в поверхневому шарі розчину.
(рис. 4), згідно з рівнянням (2.1) Г > 0 (рис. 5), адсорбція позитивна і ПАР накопичується в поверхневому шарі розчину.
| 
|
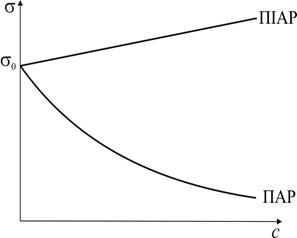
| Рис. 4. Ізотерма поверхневого натягу | Рис. 5. Ізотерма адсорбції Гіббса |
Існують речовини, зі збільшенням концентрації яких у розчині поверхневий натяг збільшується (рис. 4). В цьому випадку 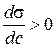 , Г < 0 (рис. 5), а адсорбція є негативною, тобто концентрація речовини в поверхневому шарі менша, ніж в об’ємі розчину. Такі речовини називаються поверхнево-інактивними (ПІАР).
, Г < 0 (рис. 5), а адсорбція є негативною, тобто концентрація речовини в поверхневому шарі менша, ніж в об’ємі розчину. Такі речовини називаються поверхнево-інактивними (ПІАР).
До поверхнево-активних належать органічні молекули, які складаються з неполярного вуглеводневого радикалу та полярної гідрофільної функціональної групи (–OH, –COOH, –SO3H та ін.). Двоїстий характер дифільних молекул проявляється при їх адсорбції на межі поділу фаз (рис. 6), коли вони орієнтуються в адсорбційному шарі полярною групою в напрямку полярної фази (наприклад, води), а неполярною – в напрямку неполярної фази (наприклад, повітря). Поверхнево-інактивними речовинами є сполуки, що добре сольватуються розчинником (сильні та слабкі електроліти, сахароза, уротропін тощо).
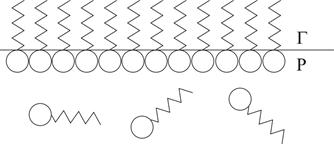
| Рис. 6. Схема адсорбції ПАР на межі поділу фаз розчин – газ у випадку граничної адсорбції: кола – полярні групи; зигзаги – неполярні радикали |
У гомологічному ряду ПАР зі збільшенням довжини вуглеводневого радикала збільшуються гідрофобні властивості речовини. Це призводить до зменшення її розчинності у воді і підвищення здатності до адсорбції.
Встановлено, що в розведених розчинах карбонових кислот або спиртів при збільшенні вуглеводневого ланцюга на одну метиленову групу
(–CH2–) поверхнева активність і відповідно здатність до адсорбції збільшуються в середньому в 3 – 3,5 рази. Ця закономірність називається правилом Траубе – Дюкло.
Зміна поверхневого натягу 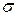 розчину ПАР з концентрацією c по відношенню до поверхневого натягу розчинника s0 описується емпіричним рівнянням Шишковського:
розчину ПАР з концентрацією c по відношенню до поверхневого натягу розчинника s0 описується емпіричним рівнянням Шишковського:
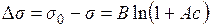 , ,
| (2.2) |
де A і B – емпіричні константи. Для розчинів ПАР 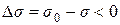 .
.
Диференціювання рівняння (2.2) по концентрації приводить до виразу
 ,
,
підстановка якого в рівняння Гіббса (2.1) дає
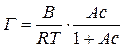 . .
|
При високих концентраціях розчину
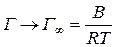 ,
,
де Г¥ – надлишкова адсорбція при максимальному заповненні поверхні (гранична надлишкова адсорбція). Звідси константа В рівняння Шишковського дорівнює
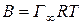
| (2.3) |
і відповідно
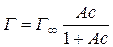 . .
| (2.4) |
Рівняння (2.4) за виглядом нагадує рівняння Ленгмюра (1.1). Величина поверхневого надлишку Г практично співпадає з абсолютною кількістю адсорбованої речовини a у поверхневому шарі, тому що концентрація адсорбату в розведеному розчині дуже мала у порівнянні з концентрацією в адсорбційному шарі. Константа A в рівняннях Шишковського (2.2) та (2.4) має такий самий зміст, що й константа K в рівнянні Ленгмюра (1.1), і є константою рівноваги процесу адсорбції.
Використовуючи рівняння Ленгмюра, можна визначити граничне (максимальне) значення адсорбції 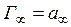 на межі поділу фаз газ/розчин. Розрахунок ізотерми повної адсорбції a = f (c), яку зображено на рис. 1, можна провести також за допомогою рівняння Ленгмюра.
на межі поділу фаз газ/розчин. Розрахунок ізотерми повної адсорбції a = f (c), яку зображено на рис. 1, можна провести також за допомогою рівняння Ленгмюра.
З теорії Ленгмюра випливає, що при досягненні граничної адсорбції на поверхні розчину утворюється щільний мономолекулярний шар з молекул ПАР (рис. 6). Це дозволяє розрахувати розміри молекул ПАР за величиною 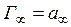 (кмоль/м2). Площа
(кмоль/м2). Площа 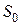 (м2), яку займає одна молекула в адсорбційному шарі, визначається за рівнянням:
(м2), яку займає одна молекула в адсорбційному шарі, визначається за рівнянням:
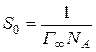 , ,
| (2.5) |
довжина молекули l в м (товщина адсорбційного шару) обчислюється за формулою:
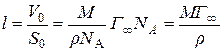 , ,
| (2.6) |
де V0 – об’єм однієї молекули ПАР; M та r – молярна маса (кг/кмоль) та густина (кг/м3) ПАР; NА – число Авогадро (6,023·1026 кмоль–1).
Читайте також:
- II.ТЕОРЕТИЧНІ ПИТАННЯ КУРСОВОЇ РОБОТИ
- IX. Відомості про військовий облік
- IX. Відомості про військовий облік
- Q Конституція України від 28 червня 1996 р. // Відомості Верховної Ради України – 1996 - № 30 – Ст. 141
- V Практично всі психічні процеси роблять свій внесок в специфіку організації свідомості та самосвідомості.
- Активне управління інвестиційним портфелем - теоретичні основи.
- Білковий обмін: загальні відомості
- Біографічні відомості
- Боротьба з проявами національної самосвідомості
- Вальниці ковзання. Загальні відомості
- Види правосвідомості
- Виникнення і розвиток свідомості у людини.
| <== попередня сторінка | | | наступна сторінка ==> |
| Лабораторна робота № 2 «ПОВЕРХНЕВИЙ НАТЯГ. | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |