
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Стислі теоретичні відомості
Основними ознаками колоїдного стану твердої речовини у системі є гетерогенність та дисперсність системи. Подрібнена речовина утворює дисперсну фазу, а безперервне середовище, в якому вона розподілена, називається дисперсійним середовищем.
Частинки дисперсної фази є не окремими молекулами, а агрегатами молекул. Розміри частинок дисперсної фази колоїдної системи суттєво більші за розміри молекул та іонів в істинних розчинах. Дисперснi ультрамiкрогетерогеннi системи з розмiрами часток дисперсної фази
10–9–10–7 м, що рiвномiрно розподiленi у дисперсiйному рідкому середовищi, називаються колоїдними розчинами або лiозолями. Таким системам притаманні сповільнена дифузія, малий осмотичний тиск, опалесценція, коагуляція (злипання часток) та електрофорез.
Колоїдні розчини можуть бути отримані шляхом диспергування або внаслідок процесів фізичної та хімічної конденсації. Фізична конденсація частинок дисперсної фази досягається утворенням її пересичених розчинів у відповідному дисперсійному середовищі. При хімічній конденсації частинки дисперсної фази з’являються у системі внаслідок перебігу в ній хімічної реакції: іонного обміну, гідролізу або окисно-відновного процесу за умови, що в результаті такої реакції утворюється малорозчинна сполука – ядро майбутньої міцели.
Для приготування колоїдного розчину шляхом хімічної конденсації необхідно проводити реакцію при низьких концентраціях реагентів (10–5 – 10–3 моль/дм3) для утворення наночасток (10–9 – 10–7 м), використовуючи при цьому значний надлишок одного з реагентів для того, щоб на поверхні кристалу (ядра) утворився подвійний електричний шар – основний чинник агрегативної стійкості.
Як приклад, розглянемо механізм утворення міцели колоїдного розчину хлориду срібла за реакцією AgNO3 + KCl = AgCl¯ + KNO3 при надлишку KCl та її будову. Якщо проводити цю реакцію при еквімолярних співвідношеннях речовин, то відбудеться осадження AgCl, але колоїдна система при цьому не утвориться. Якщо ж до розведеного розчину AgNO3 додати надлишок KCl, то у системі з’явиться велика кількість центрів кристалізації – ядер AgCl. Ядро кожної частинки цього золю складається з великої кількості (m) молекул AgCl. За правилом Панета-Фаянса на поверхні ядра з розчину завжди адсорбуються однойменні іони, щоб добудувати кристалічну решітку ядра міцели. Оскільки в розчині у надлишку KCl, на поверхні ядра AgCl накопичується деяка кількість (n) іонів Cl–, які будуть в цьому випадку потенціалвизначаючими іонами (ПВІ). При цьому поверхня ядра набуває негативного заряду. До негативно зарядженої поверхні під дією електростатичних сил притягуються позитивно заряджені протиіони К+ також у кількості (n). Частина цих протиіонів (n – х) буде розміщена ближче до частинки в адсорбційному шарі, а частина (х) – далі від ядра, в об’ємі розчину. Таким чином, ядро, ПВІ та частина протиіонів, що розміщені у нерухомому відносно ядра шарі, складають частинку (гранулу) міцели (рис. 21). Частинка золю має заряд, проте міцела в цілому завжди є електронейтральною.
Міцели колоїдних розчинів наводять у вигляді специфічної формули. Починають запис формули з утвореного ядра міцели, далі записують потенціалвизначаючі іони (ПВІ), після них зазначають протиіони. Особливістю такого запису є те, що в ньому зображують структуру утвореної міцели, розподіляючи протиіони між адсорбційним та дифузним шарами, що дає можливість показати заряджену частинку міцели (гранулу), відокремлюючи її фігурними дужками.
|
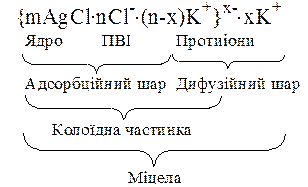
Рис. 21. Формула міцели AgCl та схема її будови
Золі можуть існувати і при цьому бути стійкими у разі, коли виконуватимуться три умови: малий розмір частинок (запобігає осіданню); наявність електричного заряду (запобігає коагуляції); сольватація частинок (запобігає їх подальшому росту).
Особливе значення мають способи одержання колоїдних систем, засновані на пептизації. При пептизації високодисперсні частинки осаду, що утворилися в результаті хімічної реакції, диспергуються до колоїдного стану. Для цього їх обробляють такими реагентами, які сприяють утворенню на поверхні частинок подвійного електричного шару (ПЕШ), внаслідок чого частинки набувають заряду і диспергуються у дисперсійному середовищі. Витрати енергії на таке утворення золю значно менші, ніж при диспергуванні твердого тіла. За механізмом утворення ПЕШ пептизацію поділяють на адсорбційну та диссолюційну. Чим більш ліофільним є осад і чим менше часу пройшло з моменту коагуляції, тим ефективнішою є пептизація.
Стійкість дисперсійної системи характеризується здатністю зберігати в часі свої основні параметри: дисперсність та рівноважний розподіл дисперсної фази в дисперсійному середовищі. Термодинамічно стійкими є лише ліофільні системи, які здатні утворюватись в результаті самочинного диспергування (DG < 0). Лiофобнi системи мають бiльший запас вiльної поверхневої енергiї, тому вони термодинамiчно нестiйкi і не здатні диспергуватись самочинно (DG > 0). Такі системи схильні до агрегації частинок, що призводить до зменшення міжфазної поверхнi і, як наслідок, до зменшення вiльної поверхневої енергiї. Укрупнення частинок дисперсної фази шляхом їх злипання називається коагуляцією. Таким чином, у ліофобних системах процес злипання часток (коагуляція) є термодинамічно вигідним і самочинним.
Коагуляція призводить до порушення агрегативної та седиментаційної стійкості, наслідком чого є випадання осаду. Коагуляцію можна спричинити зміною температури, рН розчину, введенням у систему електролітів, перемішуванням, дією сонячного світла та ін.
Найефективнішим методом коагуляції є введення в систему електролітів. Будь-який електроліт при певній концентрації може спричинити коагуляцію. Важливо лише те, щоб концентрація електроліту в системі була достатньо великою для стиснення подвійного електричного шару та зниження енергетичного бар’єру, який запобігає злипанню частинок при їх наближенні. Поріг коагуляції γ – це найменша концентрація електроліту, яка необхідна для початку коагуляція золю. Він вимірюється в моль-екв/м3.
Гарді встановив, що коагуляцію золю викликають лише іони, протилежні за знаком до заряду колоїдної частинки. Таким чином, коагуляція золів з негативно зарядженими частинками відбувається лише під впливом катіонів, а коагуляція золів з позитивно зарядженими частинками – лише під впливом аніонів.
Відповідно до правила Шульце-Гарді (правило валентності – значності) коагулююча сила іона тим більша, чим більший його заряд. При цьому коагулююча сила іона зростає значно швидше, ніж його заряд. Це емпіричне правило підтверджується теорією ДЛФО, згідно з якою поріг коагуляції золю обернено пропорційний шостому степеню заряду коагулюючого іону: 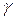 ~
~ 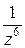 .
.
Робота 6.1.Приготування золів
Метою роботи є одержаннязолів різними методами, встановлення заряду колоїдних частинок, визначення порогу коагуляції золів.
Читайте також:
- II.ТЕОРЕТИЧНІ ПИТАННЯ КУРСОВОЇ РОБОТИ
- IX. Відомості про військовий облік
- IX. Відомості про військовий облік
- Q Конституція України від 28 червня 1996 р. // Відомості Верховної Ради України – 1996 - № 30 – Ст. 141
- V Практично всі психічні процеси роблять свій внесок в специфіку організації свідомості та самосвідомості.
- Активне управління інвестиційним портфелем - теоретичні основи.
- Білковий обмін: загальні відомості
- Біографічні відомості
- Боротьба з проявами національної самосвідомості
- Вальниці ковзання. Загальні відомості
- Види правосвідомості
- Виникнення і розвиток свідомості у людини.
| <== попередня сторінка | | | наступна сторінка ==> |
| Лабораторна робота № 6 «ОДЕРЖАННЯ ТА КОАГУЛЯЦIЯ ЗОЛІВ» | | | Хід виконання роботи |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |