
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Деякі властивості елементів та простих речовин побічної підгрупи VIII групи
| Назва еле-мента | Хімі-чний Сим-вол | Будо-ва зовніш- нього і передостаннього електронних шарів атома | Радіус атома. нм | Енергія йоніза-ціїя, E→E+, еВ | Густина, г/см | Темпера-тура плавлення, °С | Темпера-тура кипіння, °С | Стандартний електродний потенціал про- цесу E2+→E, В |
| Рутеній | Ru | 4d75s1 | 0.134 | 7.37 | 12,4 | +0.45 | ||
| Родій | Rh | 4d85s1 | 0,134 | 7,46 | 12,4 | +0.6 | ||
| Паладій | Рd | 4d105s0 | 0,137 | 8,34 | 12.0 | +0.987 | ||
| Осмій | Os | 5d66s2 | 0,135 | 8,5 | 22.5 | — | ||
| Іридій Платина | Іr | 5d76s2 | 0,135 | 9.1 | 22.4 | + 1.0* | ||
| Платина | Рt | 9d76s1 | 0.138 | 8.9 | 21,5 | + 1,188 | ||
Значення φ для процесу Іr3+ +3 для процесу Іr3+ +3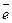 - → Ir° - → Ir°
|
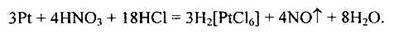 Відомі різні методи переробки самородної платини, всі вони починаються з її обробки царською водою. При цьому платинові метали, в тім числі і платина, переходять у розчин у вигляді комплексних кислот H2[MeCl6]:
Відомі різні методи переробки самородної платини, всі вони починаються з її обробки царською водою. При цьому платинові метали, в тім числі і платина, переходять у розчин у вигляді комплексних кислот H2[MeCl6]:
Осмій та іридій частково залишаються у вигляді осаду. Потім за допомогою слабких відновників платинові метали (за винятком Рі) переводять у сполуки, де ці елементи виявляють нижчі ступені окиснення, а платину осаджують у вигляді малорозчинної комплексної сполуки (NH4)2[PtCl6], яка під час нагрівання розкладається з утворенням порошкоподібної платини:
 |
Металічну платину добувають сплавлянням порошкової. Як правило, вона містить 99,7—99,8 % Рt.
Для добування платини високого ступеня чистоти процеси розчинення в царській воді й осадження у вигляді (NH4)2[PtCl6] повторюють. Застосовують також метод зонної плавки переосадженого металу.
Всі платиноїди є тугоплавкими білими блискучими металами. Вони належать до благородних металів. За кімнатної температури не піддаються корозії. Найтвердіші з них осмій, рутеній та іридій, найм'якша— платина. Платина, паладій та іридій кристалізуються у гранецентрованих кубічних ґратках, рутеній і осмій — в гексагональних щільних ґратках.
За густиною платиноїди поділяються на легкі (рутеній, родій, паладій) та важкі (осмій, іридій, платина). Найтугоплавкішим є осмій, найнижчу температуру плавлення має паладій.
Під час відновлення платиноїдів з розчинів їхніх сполук утворюються чорні дрібнодисперсні порошки, які називаються чернями. Черні завдяки дуже великій площі поверхні застосовуються як каталізатори.
Всі платиноїди здатні поглинати великі кількості водню, який утворює з ними металічні тверді розчини. Платинові метали мають широке застосування завдяки їхній стійкості проти дії різних реагентів та високим температурам плавлення. Так, родій використовують для нанесення тонких покриттів на срібні ювелірні вироби та на рефлектори прожекторів, проекційних ліхтарів.
У сучасній хімічній лабораторії широко використовуються вироби з платини — тиглі, чашки, дріт, фольга тощо.
Платино-платинородієва термопара Рt — (Рt + 10% Rh) застосовується для вимірювання температур до 1400 °С. Широко використовуються також платинові термопари опору (з підвищенням температури опір платини дуже високого ступеня чистоти зростає).
Платинові і платиновані електроди широко застосовуються в електрохімічних виробництвах і науковій роботі. З платини виготовляють найтонші дроти, необхідні для різних фізико-хімічних вимірювань: з 1 г платини можна витягнути дріт завдовжки 500 км.
Для підвищення твердості платинових сплавів до них добавляють осмій. Осмій використовують також для добування надтвердих і некородуючих сплавів.
Із сплавів іридію і вольфраму виготовляють термопари, призначені для вимірювання температур 2000—2300 °С.
Замість платини часто використовують паладій, як порівняно дешевий матеріал. Паладій наносять на контакти електричних реле, він входить до складу сплавів для зубних протезів, білого золота.
Всі платинові метали, їх сплави і сполуки використовують як каталізатори в органічному синтезі.
Тільки Рутеній та Осмій здатні виявляти у сполуках ступінь окиснення +8, що відповідає участі в утворенні зв'язків усіх s- і d-електронів атомів цих елементів. В атомах елементів, що розміщуються за Ru і Оs, внаслідок збільшення зарядів ядер електрони міцніше зв'язані, що зумовлює зменшення ступенів окиснення цих елементів. Отже, для них стійкішими є нижчі ступені окиснення.
Хімія платинових металів досить складна. Не утворюючи стійких сполук, вони здатні вбирати деякі гази, зокрема водень. Найкраще водень вбирається паладієм: в 1 об'ємі металу за кімнатної температури розчиняється до 800 об'ємів водню.
Відносно більшості речовин платиноїди дуже пасивні, особливо в компактному стані. У порошкоподібному стані вони дещо більш реакційноздатні, але з азотом платиноїди не взаємодіють навіть у разі дуже сильного нагрівання і у вигляді порошків. З вуглецем платиноїди легко утворюють нестійкі карбіди. Тому в платинових тиглях та чашках не можна нагрівати речовини, що містять Карбон, а також нагрівати платиновий посуд на полум'ї пальника, що дає кіптяву.
Оскільки оксиди платиноїдів амфотерні і руйнуються під час нагрівання з лугами за наявності кисню, в платиновому посуді не можна плавити луги, для цього використовують нікелевий, залізний або срібний посуд.
Незважаючи на високу пасивність платинових металів, добуто багато різних сполук, в яких ці елементи виявляють ступені окиснення +2 (Рd, Рt), +3 (Rh, Іr), +4 (Рt, Ru, Sr, Рd), +6 (Ru, Оs, Іr), +7 (Ru) та +8 (Оs Ru).
Всі платиноїди мають високі позитивні значення стандартних електродних потенціалів, отже, з кислотами-неокисниками вони не взаємодіють, а з кис-лотами-окисниками реагують по-різному. В концентрованих сульфатній і нітратній кислотах найкраще розчиняється паладій:
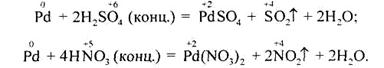 |
 Родій розчиняється в гарячій концентрованій сульфатній кислоті згідно з рівнянням реакції
Родій розчиняється в гарячій концентрованій сульфатній кислоті згідно з рівнянням реакції
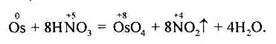 Порошкоподібний осмій здатний взаємодіяти з димучою нітратною кислотою з утворенням О5О4:
Порошкоподібний осмій здатний взаємодіяти з димучою нітратною кислотою з утворенням О5О4:
Внаслідок тривалого нагрівання за температури 120—150 °С подрібнені родій та іридій, що перебувають у заплавленій трубці, здатні розчинятися в суміші концентрованої НС1 та NaClO3:
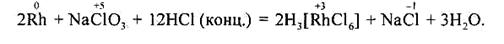 |
Під час розчинення платини і паладію в царській воді утворюються комплексні кислоти Н2[МеС16]:
 |
На решту платиноїдів кислоти та царська вода не діють, Щоб перевести в розчинний стан рутеній і осмій, останні нагрівають з сумішами NaОН + Nа2О2 або NaClO3 + NаОН. У разі нагрівання порошкоподібних рутенію й осмію з киснем утворюються RuО2 і ОsО4, з компактними металами реакція йде повільно. Гірше сполучаються з киснем родій, іридій, платина і паладій. Лише під час нагрівання до 600—700 °С вони утворюють РdO, Rh2О3, ІrО2, РtO. Однак за вищих температур РdO, Rh2O3 і ІrО2 стають термодинамічно нестійкими, і метали перестають реагувати з киснем.
Всі оксиди платиноїдів мають чорне або коричневе забарвлення, за винятком оранжевого RuО4 і безбарвного ОsО4. Сплавлянням металічного іридію з КНSО4 можна добути Іr2О3.
Оксиди платиноїдів з водою не реагують, відповідні їм гідроксиди можна добути тільки непрямим способом (під дією лугів на солі). Оксиди і гідроксиди платиноїдів амфотерні або кислотні. Оксиди рутенію (VШ) та осмію (VШ) гідроксидів не утворюють.
Платиноїди сполучаються з галогенами легше, ніж із киснем. Під час нагрівання з фтором утворюються фториди, в яких платиноїди виявляють свої найвищі ступені окиснення. З хлором та іншими галогенами платиноїди сполучаються гірше.
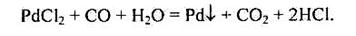 Під дією хлору на подрібнену платину за температури 250 °С утворюється РtCl2. За високих температур Рt з С12 утворює червоно-коричневий тетрахлорид РtCl4. Паладій навіть за високих температур утворює лише дихлорид. Йони Рd2+ мають електронну конфігурацію d8, яка зумовлює плоску квадратну будову комплексних сполук (як і у Nі2+). РdСl2 здатний у водному розчині реагувати з СО:
Під дією хлору на подрібнену платину за температури 250 °С утворюється РtCl2. За високих температур Рt з С12 утворює червоно-коричневий тетрахлорид РtCl4. Паладій навіть за високих температур утворює лише дихлорид. Йони Рd2+ мають електронну конфігурацію d8, яка зумовлює плоску квадратну будову комплексних сполук (як і у Nі2+). РdСl2 здатний у водному розчині реагувати з СО:
Цю реакцію використовують для виявлення СО; тільки Паладій (ІІ) за кімнатної температури здатний відновлюватись оксидом карбону (II) до металу.
Під час нагрівання осмію з хлором одночасно утворюються ОsС13 та ОsСl4.
Трихлориди родію та іридію утворюються під час взаємодії металів з хлором у разі нагрівання до температури червоного жару.
Платиноїди під час нагрівання здатні сполучатися з сіркою з утворенням сульфідів, що погано розчиняються у воді і кислотах. З водних розчинів солей платиноїдів під дією сірководню можна виділити такі сульфіди: Ru2S3, Rh2S3,
РdS, ОsS4, Іr2S3 та РtS2.
Нагріванням платиноїдів з фосфором, арсеном, стибієм, бісмутом можна добути сполуки РtР2, RuР3, РdР3, РtSb2,РtAs2, РdВі2.
Відомо багато комплексних сполук платиноїдів. Зв'язок метал —ліганд у них значно міцніший, ніж у комплексних сполуках Феруму, Кобальту, Ніколу. Це зумовлено більшим зарядом ядер атомів платинових металів і зменшенням радіусів їхніх йонів внаслідок ефекту d- і f-стиснення. Відомо десятки простих сполук розглянутих металів і тисячі комплексних. У розчинах існують тільки комплексні йони платинових металів.
Під дією на хлориди паладію (ІІ) та платини (ІІ) аміаку можна добути нейтральні та катіонні комплексні сполуки [Ме(NН3)2Сl2 і [Ме(NН3)4]2+, в яких виявляється dsp2-гібридизація валентних орбіталей центрального атома.
Оскільки молекули комплексних сполук паладію (ІІ) мають плоску квадратну будову, для них відомі цис-транс-ізомери, наприклад, жовто-коричневий цис-ізомер [Рd(NНз)2С12] та оранжевий транс-ізомер [Рd(NНз)2С12]. Існує також координаційний ізомер складу [Рd(NН3)4][РdС14].
Для Платини найстійкішим є ступінь окиснення +4. Тетрахлорид платини — амфотерна сполука з переважанням кислотної функції. Під час розчинення РtС14 у воді утворюється досить сильна комплексна кислота:
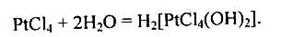 |
Розчиненням платини в царській воді добувають гексахлороплатинат-ну (ІV) кислоту Н2[РtС16]. Це сильна кислота, добуто багато її солей. Під дією лугів на розчин Н2[РtСl6] відбувається послідовне заміщення йонів Сl- в комплексному йоні на йони ОН-. У разі надлишку лугу утворюються солі Ме2[Рt(ОН)6], що мають світло-жовте забарвлення. Під дією на РtС14 аміаку можна добути ряд комплексних сполук від [РtС14(NН3)2] до [Рt(NН3)6]С14, в яких виявляється d2sp3-гібридизаціявалентних орбіталей, що зумовлює октаедричну структуру комплексних сполук.
Для Платини (П) відома тетраціаноплатинатна (ІІ) кислота Н2[Рt(СN)4], що має червоне забарвлення, є досить стійкою сполукою і сильним електролітом. Для Rh3+ і Іr3+ відомі галогенідні комплексні сполуки Nа3[RhС16] ∙12Н2О та Na3[ІrС16]. Вважають, що в розчині сульфату родію, що має жовте забарвлення, цей метал входить до складу катіонного комплексу [Rh(Н2О)6]3+, а в розчині сульфату родію, що має червоне забарвлення,— до складу аніонного [Rh(SО4)2(Н2О)2] . Досить стійкими комплексними сполуками Родію (ІП) єаміачні та змішані комплексні сполуки.
Відновленням ОsО4 концентрованою хлоридною кислотою з наступним випарюванням розчину над Р2О5 виділено червону гексахлороосматну (ІV) кислоту Н2[ОsС16] ∙ 6Н2О та її сіль Na2[ОsС16]. Відомі також Н2[ІrС16] і гало-генокомплекси платиноїдів(ІN) (Н2[IrВr6], Н2[РtВr6] тощо).
Паладій під час розчинення в царській воді, як уже зазначалось, теж здатний утворювати комплексну кислоту, подібну до Н2[РtС1б]. Проте після видалення НNO3 випарюванням з НСl гексахлоропаладатна(ІV) кислота перетворюється на червону тетрахлоропаладатну (ІІ) кислоту.
Як і у випадку Н2[РtС16], під дією лугів на комплексні йони [ІrСl6]2- і [РdС16]2- відбувається послідовне заміщення лігандів хлору на гідроксильні йони з утворенням йонів [ІrС12(ОН)4]2-, [РdС12(ОН)4]2~.
Комплексні сполуки, у яких центральний атом виявляє ступінь окиснення +8, може утворювати лише Осмій.
Незважаючи на координаційну насиченість ОsО4, оксид осмію(VIII) розчиняється у воді, що свідчить про здатність Осмію підвищувати своє координаційне число. Тому ОsО4 здатний утворювати продукти приєднання з лугами К2[ОsО4(ОН)2], а з фторидами рубідію та цезію — Ме2[О3О4Р2].
Слід пам'ятати, що і RuО4, і ОsО4 легко випаровуються за кімнатної температури, вони отруйні, подразнюють слизові оболонки органів дихання та очей через окиснювальну дію на білкові речовини.
Завдання для самоперевірки:
1. Напишіть рівняння реакцій, які треба провести для здійснення таких перетворень:
Fe2(SO4)3
/ \
Fe→ FeSO4 Fe(OH)3
\ /
Fe(OH)2
Рівняння реакцій, що відбуваються в розчинах, напишіть у скороченій йонній формі.
2. Масова частка вуглецю в чавуні становить 3,6%. Вуглець міститься у сплаві у вигляді сполуки карбіду феруму Fe3С. Визначте масову частку карбіду феруму в чавуні.
3. Методом електронного балансу доберіть коефіцієнти у схемах окисно-відновних реакцій за участі сполук хрому:
а) Cr2(SO4)3+Br2+NaOH→Na2CrO4+NaBr+ Na2SO4+H2O;
б) KІ+K2Cr2O7+ H2SO4→І2+ Cr2(SO4)3+ K2SO4+H2O;
в) SnCl2+ K2Cr2O7+HCl→ SnCl4+ CrCl3+KCl+ H2O;
г) Cr(NO3)3+ KMnO4+ H2O→ H2Cr2O7+Mn(NO3)2+KNO3+ HNO3
д) Na2S+Na2CrO4+ H2O→ Na [Cr(OH)4(H2O)2]+ NaOH
Зазначте, в яких реакціях сполуки хрому є окисниками, а в яких відновниками.
Читайте також:
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- IV. Запасні речовини
- L2.T4. Транспортування рідких, твердих та газоподібних речовин.
- L2.T4/1.Переміщення твердих речовин по території хімічного підприємства.
- Аварії з викидом (загрозою викиду) сильнодіючих отруйних речовин на об'єктах економіки.
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аваріїз витоком сильнодіючих отруйних речовин.
- Агітація за і проти та деякі особливості її техніки.
- Агрегатні стани речовини
- АДАПТАЦІЯ ОБМІНУ РЕЧОВИН ДО М'ЯЗОВОЇ ДІЯЛЬНОСТІ
- Аеродинамічні властивості колісної машини
| <== попередня сторінка | | | наступна сторінка ==> |
| Деякі властивості елементів та простих речовин побічної підгрупи VI групи | | | Особистість дошкільника з порушенням мовлення |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |