
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Деякі властивості елементів та простих речовин побічної підгрупи VI групи
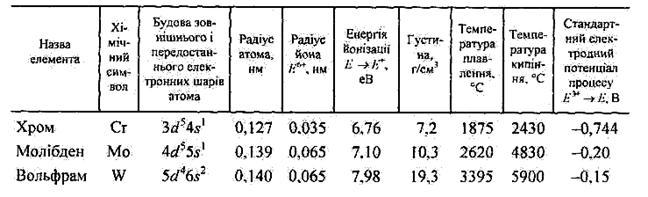 |
Максимальна ковалентність Хрому та його аналогів дорівнює 9, при цьому для їхніх атомів найхарактерніші d2sp3- і d3s (sp3)-гібридизовані стани, що відповідають координаційним числам 6 і 4. Відомі також сполуки, в яких координаційне число Мо і W дорівнює 8.
У сполуках Сr, Мо, W виявляють ступені окиснення від +1 до +6. Стійкими ступенями окиснення для Хрому є +3 і +6, для Молібдену і Вольфраму здебільшого +6.
На відміну від елементів підгрупи Ванадію, для яких найстійкішим є найвищий ступінь окиснення +5, у підгрупі Хрому високу стабільність виявляють не тільки сполуки зі ступенем окиснення елемента +6, а й +3 (Хром), +4 (Молібден).
Як і інші d-елементи, Сr, Мо, W — амфотерні, для них характерні як катіонні, так і аніонні комплекси. Із зростанням ступеня окиснення елемента стійкість аніонних комплексів зростає, а катіонних — зменшується. Наприклад, для Сr (II) характерні катіонні комплекси, для Сr(ІІІ) можливі і катіонні, і аніонні, а для Cr(VI), Mo(VI) і W(VI) — аніонні,
Вміст Хрому в земній корі становить 3,5 · 10-2 %. Хром трапляється в природі тільки у зв'язаному стані. Основним мінералом Хрому є хромистий залізняк Fe(CrO2)2- Відомо чотири стабільних ізотопи Хрому з масовими числами 50, 52, 53 і 54.
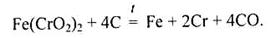 Оскільки хром використовують здебільшого для легування сталей, найчастіше виплавляють ферохром, який добувають відновленням хромистого залізняку:
Оскільки хром використовують здебільшого для легування сталей, найчастіше виплавляють ферохром, який добувають відновленням хромистого залізняку:
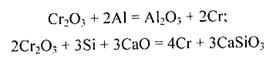 Чистий хром добувають відновленням Сr2Щ3 алюмініємабо силіцієм:
Чистий хром добувають відновленням Сr2Щ3 алюмініємабо силіцієм:
(добавляння СаО запобігає утворенню силікатів хрому).
Необхідний для добування чистого хрому Сr2О3 виділяють із хромистого сплавлянням його з содою за доступу кисню:
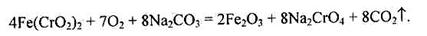 |
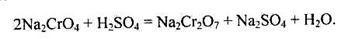 Хромат натрію, що утворився, розчиняють у воді й обробляють сульфатною кислотою:
Хромат натрію, що утворився, розчиняють у воді й обробляють сульфатною кислотою:
Na2Cr2O7 викристалізовують із розчину і далі відновлюють вуглецем:
 |
Хром високого ступеня чистоти добувають електролізом водного розчину, що містить близько 25 % оксиду хрому(VI) і до 0,2 % H2SO4.
Хром — сріблясто-білий метал, який легко піддається механічній обробці. Кристали його мають об'ємноцентровані кубічні ґратки. З хрому можна витягувати дріт і виковувати тоненькі платівки. Хром — найтвердіший з усіх металів, має високу температуру плавлення (1875 °С).
Завдяки високим твердості, корозійній стійкості та тугоплавкості хром широко використовується для легування сталей, покриття металічних виробів (хромування).
Хром однаково легко утворює сполуки, в яких виявляє ступені окиснення +3 і +6. Відомі нестійкі сполуки Хрому (ІІ), які є добрими відновниками.
Хром у ряду електрохімічних потенціалів розміщується до водню, але завдяки утворенню на його поверхні тонкої захисної оксидної плівки він майже не піддається корозії. За кімнатної температури хром хімічно малоактивний. Він може розчинятися в кислотах-неокисниках (у розбавлених розчинах хлоридної і сульфатної кислот), при цьому утворюються солі Хрому(ІІ):
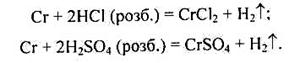 |
Солі Хрому(П), утворені сильними кислотами, розчинні у воді, з водного розчину кристалізуються у вигляді кристалогідратів: CrSO4 · 7Н2О; СrI2 · 6Н2О; СrВr2 · 6Н2О. Солі Сr(ІІ) — сильні відновники.
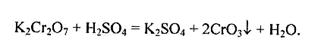 Під дією лугів на солі Хрому (ІІ) утворюється жовтий осад гідроксиду хрому (ІІ). Гідроксид хрому Сr(ОН)2 й оксид хрому (ІІ) СrO виявляють основні властивості. Хром здатний безпосередньо сполучатися з киснем з утворенням оксиду хрому (ІІІ) Сr2О3, а у вигляді дрібнодисперсного порошку на повітрі самозаймається. Найстійкішим оксидом хрому є Сr2О3. Оксид хрому (ІV) СrО3 менш стійкий; його добувають під дією концентрованої сульфатної кислоти на дихромати:
Під дією лугів на солі Хрому (ІІ) утворюється жовтий осад гідроксиду хрому (ІІ). Гідроксид хрому Сr(ОН)2 й оксид хрому (ІІ) СrO виявляють основні властивості. Хром здатний безпосередньо сполучатися з киснем з утворенням оксиду хрому (ІІІ) Сr2О3, а у вигляді дрібнодисперсного порошку на повітрі самозаймається. Найстійкішим оксидом хрому є Сr2О3. Оксид хрому (ІV) СrО3 менш стійкий; його добувають під дією концентрованої сульфатної кислоти на дихромати:
Оксид хрому (VІ) — кислотний оксид, осідає у вигляді темно-червоних кристалів голчастої форми. СrО3 — отруйна речовина (смертельна доза 0,1 г).
Оксид хрому (ІП) має зелене забарвлення, досить стійкий проти дії хімічних реагентів, його використовують як зелену фарбу; Сr2О3 і відповідний йому гідроксид Сr(ОН)3 амфотерні. Отже, в ряду СrO— Сr2О3—СrО3 основні властивості послаблюються, а кислотні посилюються: СrО — основний, Сr2О3 — амфотерний, а СrО3 — кислотний оксид.
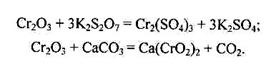 У кристалічному стані оксид хрому (Ш) має чорне забарвлення і металічний блиск, хімічно інертний, у воді, кислотах і лугах не розчиняється. Його амфотерна природа виявляється під час сплавляння з лугами, основними оксидами, карбонатами лужних металів, з дисульфатом або гідрогенсульфа-том калію:
У кристалічному стані оксид хрому (Ш) має чорне забарвлення і металічний блиск, хімічно інертний, у воді, кислотах і лугах не розчиняється. Його амфотерна природа виявляється під час сплавляння з лугами, основними оксидами, карбонатами лужних металів, з дисульфатом або гідрогенсульфа-том калію:
+2
Хроміти типу Ме(СrО2)2 є координаційними полімерами, тобто змішаними оксидами. Природним хромітом є змішаний оксид Fe(II) і Сr(ІІІ) — хромистий залізняк Fe(CrO2)2.
Гідроксид хрому(Ш) має сіро-синє забарвлення, амфотерний, добувають його під дією лугів на розчинні солі Хрому (ПІ). У разі осадження з розчинів він має змінний склад: Сr2О3 · nН2О, під час стояння поступово переходить в Сг(ОН)3 і втрачає активність. Свіжодобутий гідроксид хрому(ПІ) добре розчиняється в кислотах і лугах:
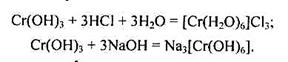
Аквакомплекс [Сr(Н2О)6]3+ має синьо-фіолетове забарвлення, як і кристалогідрати солей Хрому(ІІІ).
Солі Хрому(ІІІ), утворені сильними кислотами, добре розчиняються у воді і є сильними електролітами. З водних розчинів кристалізуються у вигляді
кристалогідратів.
Біля катіона Сr3+ можуть координуватись не тільки молекули води, а й інші ліганди. Під дією аміаку на солі Хрому утворюються такі комплексні сполуки: [Cr(NH3)4Cl2]Cl, [Cr(NH3)6](NO3)3 тощо.
За наявності таких лігандів, як CN–, SCN–, Сl–, Хром утворює координаційні сфери аніонного типу: K3[Cr(CN)6], Rb3[Cr(SCN)6], Cs3[CrCl6].
З солями лужних металів, амонію Хром(Ш) утворює подвійні солі типу галунів: NH4Cr(SO4)2 ·12Н2О, KCr(SO4)2 ·12Н2О. Кристали цих солей, як і кристали інших галунів, мають форму октаедрів, забарвлені у фіолетовий колір. Хромоамонійний галун використовується для дублення шкір і як протрава під час фарбування.
 В окисно-відновних реакціях солі Хрому(ІП) можуть виступати як відновники, що найкраще виявляється в лужному середовищі:
В окисно-відновних реакціях солі Хрому(ІП) можуть виступати як відновники, що найкраще виявляється в лужному середовищі:
| 3- |
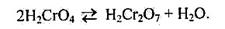 Внаслідок окиснення солей Хрому(ПІ) утворюються хромати — солі хро-матної кислоти Н2СrО4. Цю кислоту можна добути під час розчинення кислотного оксиду СrO3, у воді. Хроматна кислота Н2СrО4, як і дихроматна Н2Сг2О7, відома лише в розчині. У водних розчинах вони перебувають у стані рівноваги:
Внаслідок окиснення солей Хрому(ПІ) утворюються хромати — солі хро-матної кислоти Н2СrО4. Цю кислоту можна добути під час розчинення кислотного оксиду СrO3, у воді. Хроматна кислота Н2СrО4, як і дихроматна Н2Сг2О7, відома лише в розчині. У водних розчинах вони перебувають у стані рівноваги:
Хромати лужних та лужноземельних металів, магнію, амонію, талію, плюмбуму мають жовте забарвлення, дихромати — оранжеве. Розчинними у воді є лише солі лужних металів, магнію і кальцію. В кислих розчинах, як правило, утворюються дихромати, в лужних — хромати.
Дихромати досить термостійкі. Хроматний ангідрид, хромати і дихромати— отруйні. Хромат плюмбуму(ІІ) РbСrO4 має жовте забарвлення, під назвою «жовтий крон» використовується як жовта олійна фарба.
Відомі похідні полімерних аніонних комплексів Хрому(УІ), наприклад: К2Сr2O7 — дихромат, К.2Сг3O10— трихромат, К2Сr4O13— тетрахромат, полі-хромати К2[СrO4(СrO3)n-1]. Відповідні поліхроматам кислоти не добуті.
 Сполуки Хрому(VІ) — сильні окисники. У сухому вигляді хромати гірше вступають в окисно-відновні реакції, ніж у розчині. Сухий дихромат калію «хромпік» здатний окиснювати метали, сірку, тому його використовують у сірниковому виробництві та для виготовлення запалів. Сухий дихромат амонію під час нагрівання розкладається, що також є наслідком відновлення хрому(VІ):
Сполуки Хрому(VІ) — сильні окисники. У сухому вигляді хромати гірше вступають в окисно-відновні реакції, ніж у розчині. Сухий дихромат калію «хромпік» здатний окиснювати метали, сірку, тому його використовують у сірниковому виробництві та для виготовлення запалів. Сухий дихромат амонію під час нагрівання розкладається, що також є наслідком відновлення хрому(VІ):
Під час відновлення дихроматів у кислому середовищі утворюються похідні катіонного комплексу [Сr(Н2О)6]3+:
 |
у нейтральному середовищі – гідроксид хрому (ІІІ):
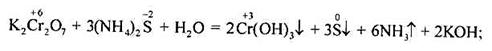 |
у лужному середовищі – похідні аніонного комплексу [Cr(OH)6]3-
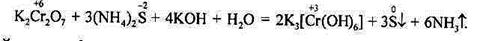 |
Йони Сr2О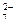 у кислому розчині взаємодіють з пероксидом гідрогену і
у кислому розчині взаємодіють з пероксидом гідрогену і
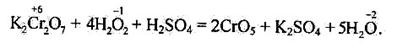 переходять у перокоид хрому, що має синє забарвлення. Реакція відбувається за рівнянням
переходять у перокоид хрому, що має синє забарвлення. Реакція відбувається за рівнянням
Пероксид хрому, розчиняючись у воді, дає надхроматну кислоту Н2СrО6. Ця реакція дуже чутлива і є якісною реакцією виявлення хрому.
Найбільшу окиснювальну активність хромати виявляють у кислому середовищі. Тому дихромат калію в суміші з концентрованою сульфатною кислотою використовують для миття хімічного посуду (хромова суміш — К2Сr2О7 + H2SO4).
Хром сполучається з галогенами дещо легше, ніж з киснем. Під час нагрівання хрому з фтором може утворитися дуже нестійкий фторид червоного кольору CrF5. Галогеніди хрому СrF3 і СrІ3 можна добути у вигляді кристалогідратів під час взаємодії Сr(ОН)3 з HF і НІ.
Під час нагрівання хрому з сіркою утворюється сульфід хрому(Ш) Cr2S3. Його можна добути також внаслідок взаємодії СrС13 з H2S. Виділити сульфід хрому(ПІ) Cr2S3 з водних розчинів неможливо, оскільки він у водних розчинах повністю гідролізує.
Хром за високої температури здатний сполучатися з вуглецем з утворенням тугоплавкого і дуже твердого карбіду хрому Сr3С2 (Сr2С).
Сполуки Хрому знаходять широке застосування. Дихромат калію часто використовують як окисник в органічних синтезах, Na2Cr2O7 2Н2О — як протраву під час фарбування, хромові галуни KCr(SO4)2 • 12Н2 ·О — під час дублення шкір, солі Хрому (Ш) — як відновники в кубовому фарбуванні. Сполуки Хрому Cr2O3, PbCrO4, Pb2(OH)2CrO4, ZnCrO4 є пігментами фарб і лаків, Сr2О3 застосовують як абразив.
У сульфідних міднонікелевих рудах платинові метали перебувають здебільшого у вигляді сполук із Сульфуром, Арсеном, Стибієм.
Найрідкіснішим серед них є рутеній, виявлений у 1844 р. казанським хіміком К. К. Клаусом і названий ним Рутенієм на честь Росії.
Самородна платина трапляється у вигляді суміші металічних сплавів, входить до складу природного сплаву іридосміну, в якому переважають іридій та осмій. Переробка цих природних сплавів зводиться до відмивання їх від пустої породи і розділення суміші металів.
Деякі властивості платинових металів подано в табл. 5.2.7 . Метали — рутеній, родій, паладій, осмій, іридій і платина — завжди трапляються разом. Загальний вміст їх у земній корі становить близько 10 б %. Існують вони переважно у вільному стані.
Таблиця 5.2.7.
Читайте також:
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- IV. Запасні речовини
- L2.T4. Транспортування рідких, твердих та газоподібних речовин.
- L2.T4/1.Переміщення твердих речовин по території хімічного підприємства.
- Аварії з викидом (загрозою викиду) сильнодіючих отруйних речовин на об'єктах економіки.
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аваріїз витоком сильнодіючих отруйних речовин.
- Агітація за і проти та деякі особливості її техніки.
- Агрегатні стани речовини
- АДАПТАЦІЯ ОБМІНУ РЕЧОВИН ДО М'ЯЗОВОЇ ДІЯЛЬНОСТІ
- Аеродинамічні властивості колісної машини
| <== попередня сторінка | | | наступна сторінка ==> |
| Деякі властивості елементів та простих речовин побічної підгрупи IV групи | | | Деякі властивості елементів та простих речовин побічної підгрупи VIII групи |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |