
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Деякі властивості елементів та простих речовин побічної підгрупи IV групи

Вміст Титану у земній корі становить 0,63, Цирконію — 25 ∙ 10-3, Гафнію— 2 ∙ 10-2 %. Елементи підгрупи Титану перебувають у природі тільки у вигляді сполук. Відомо багато мінералів Титану: рутил ТіO2, ільменіт FeTiO3, титаномагнетит FeTiO3 ∙nFe3O4 тощо.
Найпоширенішими мінералами Цирконію є циркон ZrSiO4 та баддалеїт ZrO2.
Гафній не має власних мінералів, а буває супутником Цирконію в його мінералах.
Природні Титан і Цирконій мають по п'ять ізотопів, Гафній — шість. Резерфордій у природі не трапляється, його добуто штучно.
Для добування титану руду спочатку збагачують і виділяють з неї ТіО2, який перетворюється на ТіСl4 за реакцією
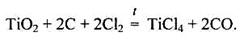 |
Тетрахлорид титану відновлюють магнієм або натрієм:
ТіС14 + 2Mg =Ті + 2MgCl2.
Для добування цирконію і гафнію концентрати силікатів відповідних елементів розкладають, спікаючи їх із фторосилікатом калію:
 |
а також піддаючи карбідизації:
 |
Карбід цирконію, що утворився, хлорують:
t
ZrC + 2Сl2 = ZrCl4 + С.
Цирконій і гафній розділити дуже важко. Для цього застосовують порційну кристалізацію K2[ZrF6] і K2[HfF6], ректифікацію летких сполук (MeС14 тощо), йонний обмін, селективну екстракцію.
Для добування металічних цирконію і гафнію їх сполуки МeСl4 або комплексні фториди відновлюють металотермічним способом (відновник— натрій):
 |
Титан, цирконій і гафній — сріблясто-білі метали, пластичні, тугоплавкі. У разі забруднення різними домішками ці метали набувають крихкості. Якщо ж у цих металах вміст домішок не перевищує 0,01 %, то їх можна кувати і витягувати в тонкий дріт. Під час нагрівання Ті, Zr і Hf здатні сильно вбирати водень і азот й утворювати при цьому гідриди і нітриди, тому зварювати ці метали можна тільки аргоно-дуговим способом. За звичайних умов титан і його аналоги стійкі проти дії води і повітря.
Завдяки високій стійкості проти корозії, легкості і жароміцності титан використовують як матеріал для будування літаків, морських суден, космічних ракет і кораблів. Титанові сплави жаростійкі. За міцністю титан переважає всі легкі сплави. Стійкість титану проти корозії та його міцність не знижуються навіть за температури 700 °С.
Властивість порошкоподібного титану вбирати гази використовують для створення глибокого вакууму в складних приладах під час дослідження плазми.
Цирконій використовують для легування сталей, у ракетобудуванні, як конструкційний матеріал в атомній техніці. Цирконій не зазнає нейтронної корозії.
Гафній має високу здатність вбирати теплові нейтрони, тому застосовується для виготовлення аварійних стержнів для ядерних реакторів.
Найхарактернішим ступенем окиснення для всіх елементів побічної підгрупи IV групи є +4. Сполуки, в яких ці елементи виявляють ступінь окиснення +2, нестійкі й окиснюються навіть на повітрі.
Сполуки елементів підгрупи Титану E(ІІ) добувають відновленням сполук, у яких вони виявляють вищі ступені окиснення: +3 і +4.
Титан, цирконій, гафній на холоді хімічно малоактивні, вони стійкі проти корозії на повітрі завдяки наявності на поверхні металу захисної оксидної плівки E О2. За кімнатної температури титан та його аналоги здатні повільно взаємодіяти з концентрованою фторидною кислотою з утворенням сполук TiF3, HfF4 (ZrF4) і H2[ZrF6] (H2[HfF6]), а також із сумішшю нітратної і фторидної кислот:
 |
Під час нагрівання активність цих металів помітно зростає. Титан, на відміну від цирконію і гафнію, здатний взаємодіяти з гарячими хлоридною, сульфатною й нітратною кислотами:
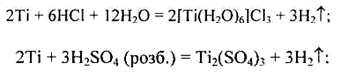 |
3Ti + 4HNO3+H2O = 3 H2 Ti O3↓+4NO↑
Під час нагрівання до температури червоного жару Ті, Zr, Hf згоряють у кисні з утворенням оксидів EО2. За температури 800 °С вони взаємодіють з азотом з утворенням нітридів EN, за температури 150—400 °С — з галогенами з утворенням галогенідів ЕГ4. У порошкоподібному стані ці метали пірофорні.
Титан, цирконій, гафній під час нагрівання з воднем утворюють гідриди £Н2, що мають структуру флюориту. Вони є проміжними сполуками між твердими розчинами і солеподібними (йонними) гідридами типу СаН2.
У разі високотемпературного відновлення ТіО2 (під дією Mg, Zn, C, Ті) утворюється золотистий оксид титану(П) ТіО, який має основний характер і добре розчиняється у H2SO4:
 |
Ця реакція ілюструє сильні відновні властивості похідних Титану (II), які, подібно до металів, здатні відновлювати розбавлені розчини кислот.
Гідроксид титану (ІІ) Ті(ОН)2 — не розчинний у воді, має чорне забарвлення, його можна добути під час взаємодії ТіГ2 з лугами. Гідроксид титану (ІІ) — сильний відновник, здатний повільно реагувати з водою:

Добуто дихлорид титану, дифториди титану і цирконію, броміди і йодиди титану та його аналогів зі ступенями окиснення +2, однак вони малостійкі. Сполуку Hfl2 не добуто.
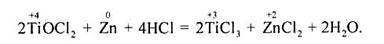 Сполуки Титану(ПІ) утворюються під дією водню на кристалічні сполуки Титану(ІУ) під час нагрівання; в розчині їх добувають відновленням активними металами в кислому середовищі:
Сполуки Титану(ПІ) утворюються під дією водню на кристалічні сполуки Титану(ІУ) під час нагрівання; в розчині їх добувають відновленням активними металами в кислому середовищі:
Сполуки Титану (III) здатні повільно відновлювати воду з виділенням водню й утворенням стійкіших сполук Титану (ІV).
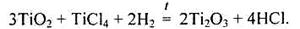 Оксид титану(ІІІ) можна добути високотемпературним відновленням ТіО2 вуглецем або за реакцією
Оксид титану(ІІІ) можна добути високотемпературним відновленням ТіО2 вуглецем або за реакцією
Під час нагрівання на повітрі і кип'ятіння з HNO3 оксид титану(ІІІ) переходить у ТіО2; оксиди Zr2O3 і Нf2О3 не добуті.
Під дією лугів на розчини солей Титану (ІІІ) виділяється осад темно-червоного кольору Ті(ОН)3, який легко окиснюється:
 |
Оксид і гідроксид титану(Ш) мають основний характер.
Добуто галогеніди ТіГ3, ZrГ3 і HfBr3. Фторид титану(ІІІ) утворюється під час розчинення титану у фторидній кислоті:
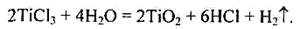 |
Хлорид титану(III) здатний диспропорціонувати на ТіС14 і ТіС12, легко окиснюється галогенами з утворенням ТіСl, окиснюється у вологому повітрі:
Сполуки Цирконію(Ш) і Гафнію(Ш) ще менш стійкі, ніж сполуки Тита-ну(Ш). Хлорид цирконію ZrCl3 в розчині не існує.
Сполуки елементів підгрупи Титану зі ступенем окиснення +4 найстійкіші і мають найбільше практичне значення. Вони існують у вигляді гідратованих катіонів, груп ЕО2+, аніонів ЕО (Ті, Zr), ЕО
(Ті, Zr), ЕО (Ті, Zr), [ЕF6]2-, [ECl6]2-тощо.
(Ті, Zr), [ЕF6]2-, [ECl6]2-тощо.
Оксиди титану, цирконію, гафнію ЕО2 мають амфотерні властивості, їх кислотна функція посилюється зі зменшенням протонного числа елементів. Так, ТіО2 виявляє переважно кислотні властивості, а НfО2 — основні.
 У межах підгрупи посилюються основні властивості оксидів ЕО2 і послаблюється їх окиснювальна активність. Проте ЕО2 через координаційну насиченість атомів металів виявляють слабкішу реакційну здатність не тільки відносно води, а й відносно кислот і лугів (особливо ZrO2). Оксид титану(ІV) розчиняється в концентрованій H2SO4 з утворенням TiOSO4, у розплавах лугів і карбонатів лужних і лужноземельних металів — з утворенням мета- й ортотитанатів:
У межах підгрупи посилюються основні властивості оксидів ЕО2 і послаблюється їх окиснювальна активність. Проте ЕО2 через координаційну насиченість атомів металів виявляють слабкішу реакційну здатність не тільки відносно води, а й відносно кислот і лугів (особливо ZrO2). Оксид титану(ІV) розчиняється в концентрованій H2SO4 з утворенням TiOSO4, у розплавах лугів і карбонатів лужних і лужноземельних металів — з утворенням мета- й ортотитанатів:
Оксиди ZrO2 і НfO2 здатні розчинятися у концентрованій фторидній кислоті з утворенням ZrF4, а також у розплавах лугів і карбонатів лужних і лужноземельних металів з утворенням метацирконатів і метагафнатів:
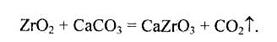 |
Тільки титанати, цирконати і гафнати лужних металів здатні розчинятись у воді, всі інші солі цього типу є нерозчинними. Кислотна функція сполук EО, і E(ОН)4 мала, тому розчинні титанати, цирконати, гафнати за наявності води сильно гідролізують з утворенням відповідних гідроксидів.
Гідроксиди E(ОН)4 — білі, погано розчинні у воді сполуки, вони здатні до утворення колоїдних розчинів.
Титан, подібно до Германію і Стануму, може утворювати гідроксиди двох форм: α- і β. α-Гідроксиду титану відповідає формула Н4ТіO4, або ТіО, ∙ 2Н2O (оститанатна кислота), β-титанатну кислоту можна записати як Н2NiO3 або ТіО(ОН)2 вона інертніша, ніж Н4ТіO4, погано розчиняється в лугах і кислотах, розчиняється тільки у фторидній, а під час нагрівання — в концентрованій сульфатній кислоті.
У разі тривалого зберігання а-титанатна кислота перетворюється на Р-титанатну кислоту. Сплавлянням Н2NiO3 з лугами залежно від кількості лугу можна добути орто-, мета- або політитанати.
Оскільки гідроксиди E(ОН)4 амфотерні, вони здатні розчинятись у сильних кислотах з утворенням розчинних солей E(SO4)2, E(NO3)4, E(С1О4)4. Малорозчинними солями Цирконію і Гафнію є йодати, фосфати, оксалати. Як солі дуже слабких основ сполуки E(SO4)2, E(NO3)4, E(lO4)4 тощо у розчині гідролізують з утворенням основних солей E(ОН)2(СlO4)2, E(OH)2SO4, E(OH)3NO3, які часто записують як солі титанілу TiOSO4, цирконілу ZrO(NO3)2, гафнілу HfOSO4. Солі карбонатної, сульфідної, нітритної та інших слабких кислот у водному розчині добути не можна.
Через високу здатність галогенідів до гідролізу їх краще добувати в сухому вигляді. В разі надлишку галогенів метали підгрупи Титану досить енергійно сполучаються з ними з утворенням сполук EГ4, які відзначаються координаційною ненасиченістю атомів металів. Від Тi Г4, до HfГ4 посилюється донорно-акцепторна взаємодія атома металу з атомами галогенів, сполученими з іншими атомами, що приводить до утворення кристалів: ТіС14 — рідина, а всі інші тетрагалогеніди — тверді речовини.
На відміну від EF4, хлориди, броміди, йодиди елементів підгрупи Титану в твердому стані мають молекулярні ґратки.
Із тетрагалогенідів найширше використовується ТіС14, з якого добувають металічний титан.
Тетрагалогеніди титану та його аналогів можуть сполучатися з галогено-водневими кислотами і відповідними галогенідами з утворенням комплексних сполук (к. ч. = 6; 8). Найлегше утворюються розчинні фториди:
 |
Одночасно утворюються фтороцирконати і фторогафнати складу Me3[EF7]
і Me4[EF8].
 Утворенням міцних фторидних комплексів можна пояснити розчинення оксидів і гідроксидів титану(ІV) та його аналогів, а також розчинення вільних металів у фторидній кислоті:
Утворенням міцних фторидних комплексів можна пояснити розчинення оксидів і гідроксидів титану(ІV) та його аналогів, а також розчинення вільних металів у фторидній кислоті:
Хлоридні комплекси елементів підгрупи Титану нестійкі, тому метали цієї підгрупи в хлоридній кислоті не розчиняються (за винятком титану).
Сульфіди TiS2 і ZrS2 можна добути під час нагрівання сірки з металами або під час сильного нагрівання оксиду ЕО2 з сірковуглецем.
Відповідні нітриди елементів ЕN можна добути не тільки прямим синтезом, а й внаслідок високотемпературної взаємодії карбідів елементів EC з азотом або оксидів ЕО2 з вуглецем і азотом.
Високотемпературним синтезом або взаємодією ЕО2 з вуглецем добувають карбіди ЕС. Карбіди, як і нітриди елементів підгрупи Титану,— кристалічні речовини, дуже тверді, тугоплавкі (3000—4000°С), добре проводять електричний струм і хімічно інертні.
Аналогічні властивості мають силіциди ЕSi2 і бориди ЕВ, ЕВ2.
Надзвичайно тверді матеріали на основі ТіС, що містять WC, також використовуються для добування твердих сплавів, з яких виготовляють свердла, різці, ТіС застосовують для видалення кисню зі сталі під час виплавляння. TiN — для шліфування коштовних каменів, із ТіВ2 виготовляють деталі турбін, турбогенераторів і ракет.
Оксид титану(ІV) ТіО2 широко застосовується в техніці, є каталізатором багатьох органічних синтезів. Білило на основі ТіО2 характеризується високою міцністю, кислото- і світлостійкістю.
Карбід цирконію ZrC використовують для різання скла і шліфування, ZrCb добавляють у шихту для виготовлення важкоплавкого скла, емалей та поливи. Розроблено технологію добування фіанітів — великих прозорих кристалів ZrO2 з домішками НfО2. Фіаніти мають дуже великий показник заломлення світла, вони тверді, міцні, хімічно надзвичайно стійкі. їх застосовують у техніці і для виготовлення прикрас.
До побічної підгрупи VI групи належать елементи Хром Сr. Молібден Мо і Вольфрам W. Всі вони є sd-елементами. Оскільки в останньому електронному шарі атомів цих елементів перебуває 1—2 електрони, вони характеризуються як метали. В табл. 26 подано деякі властивості елементів підгрупи Хрому. У ряду Сr—Мо—W збільшуються потенціали йонізації; Мо і W внаслідок лан-таноїдного стиснення мають близькі атомні та йонні радіуси, тому Молібден і Вольфрам за властивостями більше подібні один до одного, ніж до Хрому.
Таблиця 5.2.6.
Читайте також:
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- IV. Запасні речовини
- L2.T4. Транспортування рідких, твердих та газоподібних речовин.
- L2.T4/1.Переміщення твердих речовин по території хімічного підприємства.
- Аварії з викидом (загрозою викиду) сильнодіючих отруйних речовин на об'єктах економіки.
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аваріїз витоком сильнодіючих отруйних речовин.
- Агітація за і проти та деякі особливості її техніки.
- Агрегатні стани речовини
- АДАПТАЦІЯ ОБМІНУ РЕЧОВИН ДО М'ЯЗОВОЇ ДІЯЛЬНОСТІ
- Аеродинамічні властивості колісної машини
| <== попередня сторінка | | | наступна сторінка ==> |
| Підгрупи II групи | | | Деякі властивості елементів та простих речовин побічної підгрупи VI групи |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |