
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Теоретичні відомості
Вимірювальний прилад складається з посудини, заповненої водним розчином мідного купоросу (CuSO4), в який занурені мідні електроди. При проходженні електричного струму крізь розчин катіони (позитивно зарядженні іони) цього електроліту прямують до катоду; аніони (від’ємно зарядженні іони) – до аноду. На катоді катіони відновлюються до вільного металу за реакцією:
 (3.1)
(3.1)
Маса мідного катоду за рахунок цієї реакції зростає. На аноді відбувається окислення атомів міді за реакцією:
 (3.2)
(3.2)
За рахунок цієї реакції маса аноду зменшується, а концентрація електроліту лишається сталою. Постійний електричний струм при проходженні крізь електроліт здійснює електроліз. Таким чином, електроліз – це окислювально-відновлювальний процес, який відбувається на електродах при проходженні крізь електроліт постійного електричного струму.
У 1834 р. М.Фарадей експериментально встановив основні закони електролізу. Перший закон Фарадея вказує на залежність між масою речовини, яка виділилась під час електролізу і кількістю електрики, яка пройшла крізь електроліт. Цей закон формулюється так: маса речовини m, яка виділилася при електролізі, прямо пропорційна кількості електрики, яка пройшла крізь електроліт – q:
 (3.3)
(3.3)
де k − електрохімічний еквівалент речовини.
Якщо у формулі (3.3) прийняти q=1 кулону, тоді к=m, тобто електрохімічний еквівалент речовини чисельно дорівнює масі речовини, яка виділяється з електроліту при проходженні 1 кулона електрики. Для кожної речовини, яка виділяється при електролізі, електрохімічний еквівалент має певне значення.
Підставимо у формулу (3.3) значення кількості електрики як добуток сили струму I та часу t:
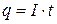 (3.4)
(3.4)
Тоді формулу (3) можна записати у вигляді:
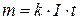 (3.5)
(3.5)
Другий закон Фарадея вказує на залежність електрохімічного еквівалента від молярної маси атомів елемента М і його валентності n. Відношення молярної маси атомів елемента до валентності називається хімічним еквівалентом простої речовини:
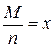 (3.6)
(3.6)
Для міді М=64; n=2.
Увівши поняття «хімічний еквівалент речовини», другий закон Фарадея можна формулювати так: електрохімічний еквівалент речовини пропорційний його хімічному еквіваленту.
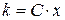 (3.7)
(3.7)
Величина С є постійною для всіх речовин, вона показує, скільки еквівалентної маси речовини виділяється на електродах при проходженні крізь електроліт 1 кулона електрики. Розрахунок показує, що для виділення еквівалентної маси речовини при електролізі необхідно, щоб крізь розчин електроліту пройшло 96500 кулонів електрики. Ця кількість електрики називається числом Фарадея, позначається F;  .
.
Другий закон Фарадея можна записати, підставляючи у формулу (3.7) значення величини з формули (3.6). Замість постійної користуються зворотною величиною F=1/С. Тоді другий закон Фарадея можна сформулювати так: електрохімічний еквівалент речовини прямо пропорційний молярній масі атомів простої речовини і обернено пропорційний валентності.
Підставляючи у формулу (3.5) значення k з формули (3.6), (3.7) та F=1/С, можна записати:
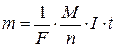 (3.9)
(3.9)
Формула (3.9) являє собою об’єднаний закон Фарадея для електролізу. З цієї формули можна знайти І – величину сили постійного електричного струму, який пройшов крізь електроліт.
 (3.10)
(3.10)
Значення сили струму за співвідношенням (3.10) визначається досить точно, оскільки F, M, n, відомі з таблиць, а похибки будуть залежати лише від точності виміру маси m та часу t. Описаний метод вимірювання сили струму дає надійні результати, які не залежать від класу точності приладів. Цей метод можна застосувати для градуювання електровимірювальних приладів та для перевірки їх показів у будь-якому місці шкали.
Порядок виконання роботи:
1) Зібрати схему за рис.3.1.
2)  Зняти катодну пластинку, промити її, висушити та зважити на аналітичних терезах (m1) з точністю до 10-5 кг. Записати одержані результати зважування.
Зняти катодну пластинку, промити її, висушити та зважити на аналітичних терезах (m1) з точністю до 10-5 кг. Записати одержані результати зважування.
3) Під’єднати катодну пластинку та занурити її в розчин. Включити тумблер на джерелі електричного струму та одночасно пустити секундомір. Протягом 30 хв. пропускати електричний струм, підтримуючи його сталим за допомогою реостата на поділці, яку вказує викладач.
4) Розімкнути електричний ланцюг. Дістати катодну пластинку з електроліту, промити, висушити її. Знову зважити на аналітичних терезах з тією ж точністю. Записати нову масу катодної пластинки m2.
5) Розрахувати масу міді m, яка виділилася на катоді з електроліту при електролізі, за формулою: 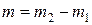 .
.
6) Визначити похибку вимірювання.
7) Розрахувати масу міді за формулою (3.9).
8) Проаналізувати отримані результати.
Контрольні запитання
1) Як залежить маса речовини, яка виділилася на електроді, від кількості електрики, що пройшла крізь електроліт?
2) Яка фізична суть електрохімічного еквівалента речовини?
3) Сформулюйте перший та другий закони Фарадея для електролізу.
4) Наведіть приклади застосування електролізу в техніці.
5) Чи можна по зміні маси катода судити про зміну маси анода?
Читайте також:
- II.ТЕОРЕТИЧНІ ПИТАННЯ КУРСОВОЇ РОБОТИ
- IX. Відомості про військовий облік
- IX. Відомості про військовий облік
- Q Конституція України від 28 червня 1996 р. // Відомості Верховної Ради України – 1996 - № 30 – Ст. 141
- V Практично всі психічні процеси роблять свій внесок в специфіку організації свідомості та самосвідомості.
- Активне управління інвестиційним портфелем - теоретичні основи.
- Білковий обмін: загальні відомості
- Біографічні відомості
- Боротьба з проявами національної самосвідомості
- Вальниці ковзання. Загальні відомості
- Види правосвідомості
- Виникнення і розвиток свідомості у людини.
| <== попередня сторінка | | | наступна сторінка ==> |
| Перевірка закону Фарадея для електролізу | | | Лабораторна робота №4 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |