
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
При підвищенні температури системи на кожні 10 градусів швидкість більшості реакцій зростає в 2—4 рази.
VT+10/VT = g = 2–4;
якщо температура змінюється не на 10 К, то користуються рівнянням:
 .
.
де g – температурний коефіцієнт швидкості хімічної реакції.
Правило Вант-Гоффа є наближеним правилом, використання його обмежене помірними температурами.
Приклад 14.
Обчислити, у скільки разів збільшиться швидкість реакції, що перебігає у газовій фазі, при підвищенні температури від 20 до 60 градусів за Цельсієм, якщо температурний коефіцієнт швидкості реакції дорівнює 3.
Розв'язання.
Згідно з правилом Вант-Гоффа: V(T2)/V(T1) = g DT/10 = 340/10 = 81.
Більш точно залежність швидкості реакції від температури описується емпіричним рівнянням Арреніуса:
k = A ´ e–E(акт)/(RT),
де k– константа швидкості реакції, А – константа для кожної реакції, е – основа натурального логарифма, Еакт – енергія активації, R – газова стала, Т – температура.
Енергія активації – це надлишкова енергія в порівнянні з середньою, яку повинні мати реагуючі частинки, щоб їхні зіткнення спричинили хімічні взаємодії:
Еакт = Е* – Есер.
Енергія активації залежить від природи реагуючих речовин та присутності каталізатора.
Приклад 15.
Як зросте швидкість реакції при підвищенні температури з 400 до 450К, якщо відомо, що енергія активації цієї реакції дорівнює 300 кДж/моль?
Розв'язання.
Запишемо рівняння Арреніуса для двох температур.
k400 = A ´ e–E(акт)/(R ×400), k450 = A ´ e–E(акт)/(R ×450),
При однакових концентраціях відношення швидкостей реакцій буде дорівнювати відношенню констант швидкості:
V450/V400 = k450 / k400 = e–E(акт)/R (1/ 450 – 1/400)
Після логарифмування будемо мати:
ln(k450 / k400) =(–300000/8.314 ) × (1/450–1/400) =10,02
k450 / k400 = 22471
Речовини, які прискорюють швидкість реакції, але не витрачаються в результаті її перебігу, називаються каталізаторами (позитивними каталізаторами). Речовини, які сповільнюють швидкість реакції, називаються інгібіторами (негативними каталізаторами).
Формально вплив каталізатора на швидкість реакції визначається рівнянням Арреніуса. Але, на відміну від використання цього рівняння в попередньому прикладі, температура буде сталою, а змінюється енергія активації.
Приклад 16.
Введення каталізатора при Т=300 К підвищило швидкість реакції в 100 разів. Як каталізатор змінив енергію активації?
Розв'язання.
Запишемо рівняння Арреніуса для випадку відсутності каталізатора (1) та його наявності (2)
k 1= A ´ e–E1/(RT); k 2= A ´ e–E2/(RT);
k 2/ k 1 = e E1–E2/(RT);
ln(k2 / k1)= ( E1–E2)/(RT);
(E1–E2) = RT ln(k2 / k1) = 8,314 × 300 ln(100) =11482Дж/моль = 11,482 кДж/моль.
В пожежній справі широко використовуються інгібітори горіння. Найбільш поширеними інгібіторами горіння, які діють як гомогенні інгібітори, є галогенпохідні вуглеводнів. Розкладаючись в полум'ї на радикали, вони блокують найбільш реакційно здатні частки в полум'ї і, таким чином, гальмують процес горіння. В якості гетерогенних інгібіторів горіння застосовують дрібні порошки деяких солей: карбонат та гідрокарбонат натрію, фосфати лужних металів.
Ланцюговими називаються реакції, які включають велику кількість стадій, що відбуваються послідовно. Здійснення цих реакцій зумовлене наявністю вільних радикалів, які перетворюють неактивні молекули на активні. (Вільні радикали – це частки, які мають неспаровані електрони; більшість вільних радикалів дуже реакційно здатні і не можуть накопичуватися в значних кількостях).
Згідно з теорією Зельдовича, для виникнення процесу горіння потрібно, щоб у деякому об'ємі швидкість тепловиділення перевищувала швидкість тепловіддачі.
Запитання для самоконтролю
1. Що таке швидкість хімічної реакції?
2. Від яких факторів залежить швидкість реакції?
3. Як впливають на швидкість хімічних реакцій температура, концентрація реагуючих речовин, каталізатор?
4. Що таке константа швидкості?
5. Що таке енергія активації?
6. Сформулюйте закон діючих мас для швидкості хімічної реакції.
7. Що таке температурний коефіцієнт швидкості хімічної реакції?
8. Який механізм хімічної реакції називають ланцюговим?
9. За яким механізмом відбуваються процеси горіння?
10. Що таке інгібітори горіння? Як вони використовуються в пожежній справі?
Тема 7. Хімічна рівновага
Стан системи реагуючих речовин (оборотної реакції), за яким швидкості прямої та зворотної реакцій стають однаковими, називається хімічною рівновагою.
В стані хімічної рівноваги кількості вихідних речовин і продуктів реакції не змінюються, оскільки реакція відбувається в обох напрямках з однаковимишвидкостями. Ось чому стан хімічної рівноваги має рухомий, динамічний характер.
З точки зору хімічної термодинаміки в стані хімічної рівноваги енергія Гіббса системи має найменше значення.
Кількісною характеристикою хімічної рівноваги є її константа. Для реакції:
aА + вВ = dD = fF
 ,
,
де [ ] позначають рівноважну концентрацію.
Для будь-якої реакції константу рівноваги можна записати:

де 
 - добуток концентрацій кінцевих та початкових речовин в ступенях, що дорівнюють стехіометричним коефіцієнтам.
- добуток концентрацій кінцевих та початкових речовин в ступенях, що дорівнюють стехіометричним коефіцієнтам.
Константа хімічної рівноваги визначає глибину перебігу процесу в момент досягнення стану рівноваги. За допомогою константи рівноваги можна обчислювати рівноважні концентрації речовин, що беруть участь в реакції.
Приклад17.
Вихідні концентрації хлору та водню в реакції синтезу хлороводню складали 1 моль/л. Визначити рівноважну концентрацію хлороводню після досягнення стану рівноваги. Константа рівноваги для цієї реакції дорівнює 4.
Розв'язання.
Запишемо рівняння реакції: H2 + Cl2 = 2HCl.
Нехай до моменту встановлення рівноваги концентрація хлору зменшилась на Х моль/л, тоді концентрація водню теж зменшиться на Х моль/л (за рівнянням реакції хлор та водень реагують у співвідношенні 1:1) . Концентрація хлороводню буде складати 2Х ( з рівняння реакції бачимо, що з 1 моль Cl2 утворюється 2 моль хлороводню)
Запишемо рівноважні концентрації всіх речовин, що беруть участь в реакції:
H2 – (1–Х)
Cl2 – (1–Х)
HCl – (2Х)
Підставимо ці концентрації у вираз для константи рівноваги.
 , звідси х = 0,5, 1–х = 0,5, 2х = 1.
, звідси х = 0,5, 1–х = 0,5, 2х = 1.
Відповідь: концентрації водню та хлору будуть 0.5 моль/л, а концентрація хлороводню буде 1 моль/л.
Приклад 18.
В посудині об'ємом 0,5 л змішали 0.5 моля водню та 1.0 моль вуглекислого газу. Обчислити константу рівноваги реакції:
CO2 + H2 = CO + H2O(г) ,
якщо відомо, що до моменту встановлення рівноваги прореагувало 50% водню.
Розв'язання.
До моменту встановлення рівноваги прореагувало (0.5´50)/100=0,25 моль водню. Згідно з рівнянням реакції, прореагувало вуглекислого газу 0,25 моль і утворилось води та оксиду вуглецю (ІІ) по 0,25 моль. Рівноважні кількості (CO2, H2, CO, H2O) складуть 0.75; 0,25; 0,25; 0,25 моль. Концентрації цих речовин відповідно складуть: ( С=n/V): 1,5; 0,5; 0,5; 0,5 моль/л.
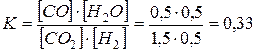
Термодинаміка дає універсальне співвідношення між стандартною зміною енергії Гіббса і величиною константи хімічної рівноваги:
DG0 = –RTlnK.
Приклад 19.
За допомогою таблиць стандартних термодинамічних величин визначити константу рівноваги реакції синтезу аміаку.
Розв'язання.
1. Запишемо рівняння реакції: N2 + 3H2 = 2 NH3
2. За допомогою таблиць стандартних термодинамічних величин розрахуємо зміну енергії Гіббса для цієї реакції:
DG0х.р.= 2 DG0f(NH3) – DG0f(N2) – 3DG0f(H2) = 2 (–16,7) = –33,4 кДж/моль
3. Розрахуємо константу рівноваги.
DG0 = –RTlnK, lnK = – DG0/RT = 33,4·103/(8.314×298) =13,4; К = е13,4 =
= 6.6 ×105.
Принцип Ле–Шательє (принцип рухомої (динамічної)) рівноваги:
якщо на систему, що перебуває у стані рівноваги, подіяти ззовні, то в системі відбуватимуться зміни, що послаблюють або знищують цю дію.
Читайте також:
- I. Органи і системи, що забезпечують функцію виділення
- I. Особливості аферентних і еферентних шляхів вегетативного і соматичного відділів нервової системи
- II. Анатомічний склад лімфатичної системи
- IV. Розподіл нервової системи
- IV. Система зв’язків всередині центральної нервової системи
- IV. Філогенез кровоносної системи
- POS-системи
- T. Сутність, етіологія та патогенез порушень опорно-рухової системи
- VI. Філогенез нервової системи
- Vу -швидкість ударника
- А) Заробітна плата її форми та системи.
- А) Заробітна плата, її форми та системи.
| <== попередня сторінка | | | наступна сторінка ==> |
| Тема 6. Хімічна кінетика | | | Вплив концентрації на стан рівноваги. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |