
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
У рівних об’ємах різних газів за однакових умов міститься однакове число молекул.
У символічній формі закон записується так:
N=const, якщо P,V,T = const.
Закон Авогадро був доведений у молекулярно-кінетичній теорії газів. Закон Авогадро, газові закони Гей-Люссака і Бойля-Маріотта належать до законів ідеальних газів, щодо яких можна практично знехтувати міжмолекулярною взаємодією і власним об'ємом молекул.
Залежність об' єму газу від умов, за яких він знаходиться, виражається законом Шарля - Гей-Люссака:

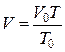
і законом Бойля - Маріотта:
PV = const.
Зв'язок між тиском, об'ємом і температурою (p, V, T) описується рівнянням стану ідеальних газів. Зазвичай вимірювання об'ємів газів проводиться за фізичних умов, відмінних від нормальних. Для надання об'єму газу нормальних умов зручно застосовувати рівняння, що об'єднує закони Бойля-Маріотта і Шарля-Гей-Люссака:
|
 . (1)
. (1)
Під час обчислень слід враховувати поправку на тиск водяної пари. Він за різної температури має своє певне значення, характеризується, як і кожен газ у суміші, парціальним тиском відповідно до встановленого Дальтономзакону парціального тиску:
Читайте також:
- D називається обмеженою зверху (знизу), якщо існує число М
- IV. Закони ідеальних газів.
- Адаптаційні зміни суглобово-зв'язкового апарату спортсменів різних спеціалізацій.
- Але різних за значенням
- Але різних за значенням.
- Аналіз витрат від різних видів діяльності
- Аналіз складу газів
- Аналіз формування доходів підприємства від різних видів діяльності
- Анатерм-114 є клеєм -герметиком прискореного затвердіння, що дозволяє використовувати його у конвеєрних виробництвах при складанні різних вузлів і деталей.
- Анатомо-фізіологічні особливості організму людини різних вікових періодів, які впливають на фармакокінетику й фармакодинаміку ЛП.
- Арифметичні операції в різних системах числення
- Банк і клієнт укладають кредитну угоду, у якій міститься низка умов, що є обов'язковими для позичальника.
| <== попередня сторінка | | | наступна сторінка ==> |
| За умов сталих тиску й температури об'єми реагуючих між собою газів, а також об'єми газоподібних продуктів реакції відносяться як невеликі ці лі числа. | | | Тиск суміші газів, які хімічно не взаємодіють один із одним, дорівнює сумі їх парціальних тисків. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |