
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Тиск суміші газів, які хімічно не взаємодіють один із одним, дорівнює сумі їх парціальних тисків.
Візьмемо 1 моль газу. Тоді за законом Авогадро за однакових фізичних умов об'єми 1 моля всіх газів повинні бути однакові, оскільки в них міститься однакове число молекул, що дорівнює сталій Авогадро NA, і величина Р0V0/T0 буде мати стале значення R=8,31 Дж/моль×К (універсальна газова стала). Рівняння (1) набуває такого вигляду:
PV = RT,
а для кількості речовини n (моль) = m/M –
 чи
чи 
Цей вираз називається рівнянням Менделєєва-Клапейрона.
Наслідки із закону Авогадро:
1)за нормальних тиску й температури 1 моль будь-якого газу займає об'єм 22,4 л;
2)густини двох газів за однакових тиску й температури прямо пропорційні їх молярним масам:
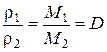 .
.
Відносна густина газу (D) дорівнює відношенню молярної маси газу до молярної маси газу, взятого за зразок.
5. Закон еквівалентів, або еквівалентних відношень, відкритий Ріхтером у 1792 р. Але перш ніж дати визначення закону слід ввести поняття еквівалента, фактора еквівалентності, молярної маси еквівалента.
 Розв’язування ряду розрахункових задач із хімії значно спрощується, якщо застосовувати поняття хімічних еквівалентів. Воно відіграло революційну роль у хімії в минулому столітті, коли формувалися поняття про атоми, молекули, атомні маси й валентності.
Розв’язування ряду розрахункових задач із хімії значно спрощується, якщо застосовувати поняття хімічних еквівалентів. Воно відіграло революційну роль у хімії в минулому столітті, коли формувалися поняття про атоми, молекули, атомні маси й валентності.
На основі рівняння хімічної реакції
2H2 + O2 = 2H2O
|
|
m(H2) : m(O2) = 4:32= 1:8. Це масове відношення для
даної реакції стале.
Отже, можна стверджувати, що в реакцію з 1/2 молекули водню (її маса дорівнює 1/2×2=1) вступають 1/4 молекули кисню ( її маса становить 1/4×32=8). При цьому відношення кількості молекул водню до кількості молекул кисню також дорівнює 1/2:1/4 = 2:1.
Згідно із сучасними уявленнями хімічні еквіваленти– це умовні частинки речовини, їх у z разів менше, ніж реальних частинок, що відповідають певній хімічній формулі.
Реальні частинки: H2 O2 H2O
Хімічні еквіваленти: 1/2H2 1/4O2 1/2H2O
Число z називають еквівалентним числом, z ³ 1. Значення z встановлюють за хімічною реакцією, у якій бере участь дана речовина. Обернену величину еквівалентного числа 1/z називають фактором еквівалентності.
Еквівалент–це реальна чи умовна частинка речовини, яка в певній кислотно-основній реакції еквівалентна (рівноцінна) одному катіону Гідрогену чи в певній окисно-відновній реакції - одному електрону.
Число, що визначає, яка частка реальної частинки речовини еквівалентна одному катіону Гідрогену в певній кислотно-основній реакції чи одному електрону в певній окисно-відновній реакції, називають фактором еквівалентності- fекв. Фактор еквівалентності не має розмірності. Його розраховують на підставі стехіометричних коефіцієнтів певної хімічної реакції. Наприклад,
а) Н2S + 2NaOH = Na2S + 2H2O.
У реакції беруть участь 2 катіони Гідрогену кожної молекули гідроген сульфіду. Таким чином, двом катіонам Гідрогену еквівалентна одна частинка (молекула) гідроген сульфіду, а одному катіону Гідрогену еквівалентна 1/2 молекули H2S. Тобто fекв(H2S) = 1/2.
б) H2S + NaOH = NaHS + H2O.
У реакції беруть участь тільки по одному катіону Гідрогену кожної молекули H2S. Так, одна молекула гідроген сульфіду еквівалентна одному катіону Гідрогену. Тобто fекв (Н2S) = 1.
в) 2H2S + 3O2 = 2H2O + 2SO2 – окисно-відновна реакція.
Ступінь окиснення Сульфуру змінюється від (–2) до (+4). Молекула H2S віддає 6 електронів, тобто одна молекула Н2S еквівалентна 6 електронам, а одному електрону еквівалентна 1/6 молекули гідроген сульфіду, тобто fекв (H2S) = 1/6.
Отже,
1)еквівалент однієї і тієї ж речовини може бути різним залежно від того, у якій реакції бере участь ця речовина, тобто для того щоб розрахувати еквівалент і фактор еквівалентності, необхідно вказати, про яку реакцію йде мова.
2)фактор еквівалентності може дорівнювати 1 і бути меншим за 1.
Кількість еквівалентів вимірюється в молях, як і будь-яка кількість речовини.
Молярна маса еквівалентів – це маса еквівалентів кількістю 1 моль, вона дорівнює добутку фактора еквівалентності на молярну масу речовини:
 .
.
За аналогією з молярною масою можна записати
 г/моль.
г/моль.
Для реакції а) Н2S + 2NaOH = Na2S + 2H2O Мf(H2S) = 1/2×34 = 17 г/моль;
б) H2S + NaOH = NaHS + H2O Mf(H2S) = 1×34 = 34 г/моль;
в) 2H2S + 3O2 = 2H2O + 2SO2 Mf(H2S) = 1/6×34 = 5,68 г/моль.
Молярні маси еквівалентів таких речовин, як водень і кисень, є сталими величинами:
Mf(Н2) = М(1/2H2) =  = 1 г/моль;
= 1 г/моль;
Мf(О2) = М(1/4О2) =  = 8 г/моль.
= 8 г/моль.
Тепер можна сформулювати закон еквівалентних відношень:
маси (об’єми) реагуючих речовин пропорційні молярним масам (об’ємам) їх хімічних еквівалентів:
 ;
;
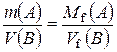 ,
,
де Vf – еквівалентний об’єм газоподібної речовини.
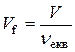 , л/моль.
, л/моль.
За нормальних умов еквівалентний об’єм дорівнює Vf = f× 22,4 л/моль.
Vf(Н2) = 1/2×22,4 = 11,2 л/моль; Vf(О2) = 1/4×22,4 = 5,6 л/моль
Із закону еквівалентних відношень випливає, що в хімічні реакції вступають речовини в еквівалентному відношенні:
nекв(А) = nекв(В).
Для визначення молярних мас еквівалентів складних сполук необхідно враховувати хімічну реакцію, у якій бере участь дана речовина і клас, до якого належить ця речовина (див. табл. 1).
Таблиця 1. Визначення молярних мас еквівалентів сполук

| Хімічна сполука | Формула сполуки | Молярна маса еквівалентів |
| Елемент (в сполуці) | Аb+ (АаВв) | 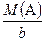
|
| Оксид | А2Ов |  = Mf(А) + Мf(О) = Mf(А) + 8 = Mf(А) + Мf(О) = Mf(А) + 8
|
| Кислота | HaB |  = Mf(Н) + Мf(Вa-) = 1 + М(B)/a = Mf(Н) + Мf(Вa-) = 1 + М(B)/a
|
| Основа | A(OH)b | М[A(OH)b]/b =Mf(А)+Mf(ОН)=М(А)/b+17 |
| Сіль | AaBb |  = = 
|
Читайте також:
- L2.T4/1.Переміщення твердих речовин по території хімічного підприємства.
- А. Визначення розмірів і площі зони хімічного зараження.
- Аварії на хімічно небезпечних об’єктах.
- Аварії на хімічно-небезпечних об’єктах та характеристика зон хімічного зараження.
- Аварійне та довгострокове прогнозування хімічної обстановки
- Алгебраїчна сума струмів у вузлі дорівнює нулю.
- Аналіз суміші сухих солей (НДРС).
- Аналіз суміші, що містить осад.
- Біохімічного складу жовчі (дисхолією).
- В-88 Квантування електронних орбіт і виникнення хімічного зв’язку в твердих тілах
- Види електрохімічної обробки
- Визначення параметрів зон хімічного забруднення
Переглядів: 1209
| <== попередня сторінка | | | наступна сторінка ==> |
| У рівних об’ємах різних газів за однакових умов міститься однакове число молекул. | | | ПІДСУМКИ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |