
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Енергія активації
Як уже зазначалося, умовою елементарного акту взаємодії є зіткнення реагуючих часток. Однак не кожне зіткнення може обумовлювати хімічну взаємодію. Насправді вона передбачає перерозподіл електронної густини, утворення нових хімічних зв’язків і перегрупування атомів. Таким чином, енергія реагуючих часток повинна бути більша за енергію відштовхування (енергетичний бар’єр) між їх електронними оболонками.
Унаслідок перерозподілу енергії частина молекул у системі завжди має певний її надлишок порівняно із середньою енергією молекул. Тому вони можуть подолати енергетичний бар’єр і вступити в хімічну взаємодію. Такі реакційноздатні здатні молекули називають активними.
Різниця між середньою енергією системи і енергією, необхідною для перебігу реакції, називається енергією активації реакції. Вона потрібна для подолання енергетичного бар’єра.
Наявність енергетичного бар’єра є причиною того, що багато реакцій, перебіг яких повністю можливий, самовільно не починаються. Наприклад, вугілля, деревина, нафта, здатні окиснюватися й горіти на повітрі, за звичайних умов не спалахують. Це пов’язано з великою енергією активації відповідних реакцій окиснення. Підвищення температури збільшує кількість активних молекул, тому дедалі більше молекул кисню, вугілля, деревини, нафти набувають необхідного запасу енергії для початку реакції. За певної температури швидкість реакції досягає певної величини, і починається реакція горіння.
Щоб почали утворюватись нові хімічні зв'язки, повинні бути ослаблені або розірвані зв'язки між атомами у вихідних молекулах. Для цього потрібно затратити енергію. Так, у реакції водню з йодом:
Н2 + І2 = 2НІ
під час зіткнення молекул починають подовжуватись зв'язки Н—Н та І—І. Вони послаблюються і тільки тоді утворюються нові зв'язки Н—І. У результаті виникає угруповання, яке називають активованим комплексомабоперехідним станом.
Після утворення перехідного стану відбувається процес подальшої побудови нових зв'язків і остаточного розриву вихідних. Хімічне перетворення можна подати у вигляді такої схеми (рис. 16):

|
Вихідні речовини ® Перехідний стан ® Продукти реакції
Рис. 16. Схема взаємодії водню та йоду
Зміну енергії реагуючих часток під час хімічного перетворення можна відобразити на енергетичній діаграмі, абсцисою якої є координата реакції, пов'язана з між'ядерними відстанями (рис. 17).

|
а б
Рис. 17. Енергетичні діаграми:
а – екзотермічної реакції; б – ендотермічної реакції
Таким чином, під час хімічного процесу зміна енергетичного стану Евих. вихідних речовин на енергетичний стан Епр. здійснюється через енергетичний бар’єр, який дорівнює енергії активації системи Е0. При цьому тепловий ефект реакції
DН = Епр. – Евих..
Під час ендотермічної реакції енергія продуктів реакції більша, ніж енергія вихідних речовин (рис. 17, б), для екзотермічної - навпаки, енергія продуктів менша за енергію вихідних речовин (рис. 17, а). Однак в обох випадках між вихідними речовинами і продуктами реакції утворюється активований комплекс, що має підвищену енергію.
Різницю енергій перехідного стану та вихідних речовин називаютьенергією активаціїабопотенціальним бар'єромреакції.
Отже, у процесі хімічного перетворення можуть бути задіяні не всі молекули, а тільки так звані активні, тобто ті, що мають енергію, достатню для утворення перехідного стану.
Енергія активації DЕакт. – важлива характеристика хімічних перетворень. Саме вона затримує чи робить неможливими багато реакцій, які з позиції термодинаміки можуть відбуватися самочинно.
Таким чином, існування більшості молекул, кристалічних речовин і навіть живих клітин можливе тому, що процеси їх перетворення і руйнування пов’язані з подоланням значного енергетичного бар’єра.
Підвищення температури реагуючих часток унаслідок зростання швидкості молекул зумовлює збільшення загальної енергії системи і відповідно відносного вмісту активних молекул, що рівноцінно зростанню швидкості хімічної реакції. Вплив температури й енергії активації на швидкість хімічних реакцій можна виразити за допомогою залежності константи швидкості реакції k від температури Т і енергії активації, яка має назву рівняння Арреніуса:
 ,
,
або у логарифмічній формі  ,
,
де А – множник Арреніуса, чи частотний фактор, пропорційний числу зіткнень молекул.
Якщо концентрації реагуючих речовин дорівнюють 1 моль/л, то рівняння Арреніуса дає можливість виразити залежність швидкості реакції від температури:
v 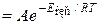 .
.
Оскільки в рівнянні температура входить у показник степеня, то швидкість хімічних реакцій значною мірою залежить від зміни температури.
Експериментально встановлено, що залежність швидкості хімічної реакції від температури можна виразити у вигляді емпіричного правила Вант-Гоффа: із підвищенням температури на кожні 10 градусів швидкість реакції зростає в 2-4 рази.
У математичній формі правило Вант-Гоффа записується так:
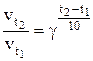 ,
,
де Dt – різниця (зростання) температур; v1 – швидкість реакції до підвищення температури; v2 – швидкість реакції після підвищення температури (при температурі t2); g - температурний коефіцієнт швидкості реакції (g=2…4).
Температурний коефіцієнтвказує, у скільки разів зросте швидкість реакції, якщо температура підвищиться на 10 градусів.
Читайте також:
- Аналогія величин і рівнянь поступального і обертального руху. Кінетична енергія обертання тіла
- Важливим параметром конденсаторів є пробивна напруга конденсатора. Чим вона більша, тим надійніший конденсатор, тим більша енергія може сконцентруватись на ньому.
- Види дезактивації
- Власна енергія зарядів.
- Внутрішня енергія і теплоємність ідеального газу
- Внутрішня енергія реального газу
- Внутрішня енергія реального газу
- Внутрішня енергія системи
- Внутрішня енергія та ентальпія
- Дефект маси і енергія зв'язку атомних ядер
- Дефект маси та енергія зв’язку ядра. Ядерні сили
- Дефект маси ядра. Енергія зв’язку ядра. Питома енергія зв’язку
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Каталіз |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |