
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Гідроліз
Реакції обмінної взаємодії в розчинах дуже поширені й відбуваються не тільки між електролітами, а й між розчиненою речовиною та розчинником. Останні називаються реакціями гідролізу.
Гідроліз –це обмінна взаємодія речовин із водою, під час якої складові частини речовини сполучаються зі складовими частинами води.
Найяскравішим прикладом такого типу обмінної взаємодії є гідроліз солей. Вимірювання рН водних розчинів солейпоказали, що часто значення водневого показника бувають більшими (лужне середовище) або меншими (кисле середовище) ніж 7. Причиною цього є взаємодія солі з водою, або процес гідролізу.
Сутність процесу гідролізу солей полягає в тому, що іони солі зв’язують складові частини води (Н+, ОН− або обидва ці іони) з утворенням малодисоційованого електроліту. Унаслідок цього рівновага процесу електролітичної дисоціації води
Н2О ↔ Н+ + ОН−
певною мірою зміщується вправо. Наприклад, перебіг реакції обмінної взаємодії солі МеА з водою, яка супроводжується зв’язуванням іонів ОН− води з катіонами металу Меn+ у слабкий електроліт, можна пояснити такою схемою:

| 
| 
| 
| 
|

| Û | 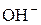
| 
| 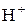
|

| ||||

| ||||
 Зміщення рівноваги процесу дисоціації води
Зміщення рівноваги процесу дисоціації води
|
Загальне рівняння гідролізу таких солей матиме вигляд
 .
.
 .
.
Для іншої групи солей перебіг процесу гідролізу забезпечується зв’язуванням іонів H+ води аніонами солі з утворенням слабкої кислоти:

| 
| 
| 
| 
|

| Û | 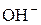
| 
| 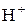
|

| ||||
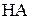
| ||||
 Зміщення рівноваги процесу дисоціації води
Зміщення рівноваги процесу дисоціації води
|
У цьому разі гідроліз солі можна описати таким іонним рівнянням:
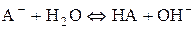 .
.
Обмінна взаємодія солі з водою посилюється в разі одночасного зв’язування іонів Н+ та ОН− води зі складовими частинами солі:

| 
| 
| 
| 
|

| 
| 
| 
| 
|

| 
| |||

| 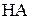
| |||
 Зміщення рівноваги процесу дисоціації води
Зміщення рівноваги процесу дисоціації води
|
Загальне рівняння гідролізу має вигляд
 .
.
Природно, що коли іони Н+ та ОН− води не зв’язуються, гідроліз солей не відбувається і рівновага процесу дисоціації води не зміщується.
Отже, гідроліз солей має місце лише тоді, коли іони води зв’язуються з іонами солі, утворюючи слабкі кислоти або слабкі основи. Звідси випливає, що гідролізу піддаються солі, утворені слабкими кислотами, слабкими основами або одночасно слабкими кислотами й основами. Солі сильних кислот та основ гідролізу не піддаються.
Гідроліз солей – це процес, зворотний до реакцій нейтралізації слабких кислот або слабких основ, які не відбуваються до кінця у зв’язку з перебігом зворотної реакції – гідролізу утвореної солі:
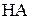
| 
| 
| 
| 
| 
| 
|
| Кислота | Основа | Сіль | ||||
 Реакція нейтралізації
Реакція нейтралізації
| ||||||
 Реакція гідролізу
Реакція гідролізу
|
Ступінь та константа гідролізу.Кількісними характеристиками гідролізу є його ступінь та константа.
Ступінь гідролізу солі (h) − це відношення концентрації солі, що піддалася гідролізу, до її загальної концентрації. Аналогічно до ступеня дисоціації ступінь гідролізу може змінюватися від 0 до 1, або від 0 до 100 %.
Оскільки гідроліз є зворотним процесом, для його характеристики можна застосувати закон діючих мас та розрахувати константу рівноваги – константу гідролізу (Кг).
Розглянемо рівняння гідролізу солі, утвореної слабкою кислотою та сильною основою:
 .
.
У розведених розчинах концентрація води є константою, тому рівняння гідролізу набуває такого вигляду:
 .
.
Помноживши чисельник та знаменник на концентрацію іонів Гідрогену [H+], одержимо:
 .
.
Таким чином, константа гідролізу солі, утвореної сильною основою та слабкою кислотою, дорівнюватиме частці іонного добутку води на константу дисоціації кислоти.
Чим слабша кислота (менше значення константи дисоціації), тим сильніше вона піддається гідролізу.
За аналогією можна довести, що константа гідролізу солі, утвореної слабкою основою та сильною кислотою, дорівнює
 .
.
А для солі, утвореної слабкими основою та кислотою
 .
.
Щоб визначити зв'язок між Кг та h, наприклад, для солі сильної основи та слабкої кислоти, треба записати іонне рівняння її гідролізу:
 .
.
Якщо позначити вихідну концентрацію солі в розчині через С (моль/л), а ступінь гідролізуh,то
 ;
;
 ;
;
 .
.
Рівняння для розрахунку константи гідролізу можна записати так:
 , або
, або  .
.
При h <<1 рівняння спрощується:
 та
та  .
.
Оскільки  , то
, то  .
.
Із останнього рівняння випливають такі важливі висновки:
1) ступінь гідролізу буде тим більшим, чим менша концентрація розчину солі;
2) гідроліз солі підсилюється із підвищенням температури розчину, оскільки при цьому збільшується концентрація іонів Гідрогену та гідроксилу (із підвищенням температури константа води зростає);
3) чим слабша кислота, аніон якої утворює сіль (тобто чим менша константа дисоціації кислоти), тим більш повним є гідроліз солі.
Читайте також:
- Білкові гідролізати
- Взаємодія йонів солі, що утворюються в результаті електролітичної дисоціації з молекулами води, називається гідролізом солі.
- ГІДРОЛІЗ АЦИЛГАЛОГЕНІДІВ.
- Гідроліз солей
- Гідроліз солей
- Гідроліз.
- Гідроліз.
| <== попередня сторінка | | | наступна сторінка ==> |
| Слід запам’ятати | | | ОКИСНО-ВІДНОВНІ РЕАКЦІЇ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |