
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
АМПЕРОМЕТРИЧНЕ ТИТРУВАННЯ З ДВОМА ІНДИКАТОРНИМИ ЕЛЕКТРОДАМИ
При звичайному амперометричному титруванні тільки один з електродів є індикаторним – це мікроелектрод, що піддається поляризації. Другим електродом – макроелектродом служать електроди порівняння (каломельний, хлорсрібний, меркур-йодидний), потенціал яких постійний. Електродні реакції проходять на індикаторному мікроелектроді.
Якщо ж занурити в той самий розчин одночасно два платинових електроди однакового розміру і накласти на них постійну напругу, то при відповідно підібраних реагентах під час титрування буде змінюватися сила струму в ланцюзі, що є функцією накладеної напруги і залежить також від концентрації іонів, які беруть участь у титруванні.
При додаванні титранту в розчині проходять хімічні реакції, концентрації компонентів увесь час змінюються.
Електродні процес з двома індикаторними електродами можна порівняти зі звичайним електролізом. У електрогравіметричному методі на аноді, більш позитивно зарядженому електроді, може проходити електроокиснення. На катоді, потенціал якого менше, ніж анода – електровідновлення. Якщо напруга, що накладається, невелика і потенціали виділення іонів не досягнуті, електроліз не проходить взагалі. Струм у ланцюзі практично відсутній. Але на відміну від електрогравіметричного методу в біамперометрії використовуються мікроелектроди, а склад розчину весь час змінюється за рахунок проходження хімічної реакції.
Напругу розкладання в електрогравіметрії розраховуємо за рівнянням:
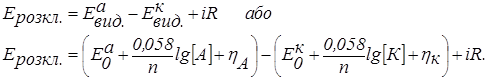
Якщо в розчині знаходяться дві солі FeSO4 і Fe2(SO4)3, то при електролізі проходять наступні електродні реакції:
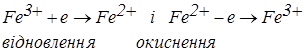
Тому що перенапруга для цих процесів дорівнює нулю, то напруга розкладання буде визначатися тільки опором у ланцюзі – величиною IR.
При знятті вольтамперних кривих солей FeSO4 і Fe2SO4 виходить зворотна катодно-анодна хвиля (рис. 5.16, кр. 3).
Як видно з наведених даних, крива 3, потенціал відновлення заліза (III) дорівнює потенціалу окиснення заліза (II). Такі сполучені пари називаються електрохімічно зворотними і їх використання перспективне в амперометричному титруванні з двома індикаторними електродами (біамперометрії).
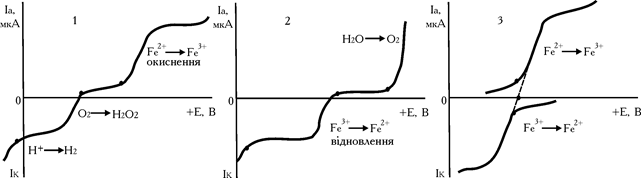
Рис. 6.16. Форма вольтамперних кривих розчинів FeSO4 (1) і Fe2(SO4)3 (2) і суміші FeSO4+Fe2(SO4)3 (3)
Розглянемо приклад титрування заліза (II) біхроматом калію. Хімічна реакція в розчині:
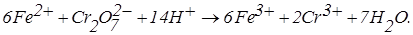
Електродні реакції на електродах при накладенні на них напруги 0,1 В (на подолання опору ланцюга):

У початковий момент в аналізованому розчині є тільки Fe2+. Сполученої пари ще немає. Струм практично дорівнює нулю. У процесі титрування 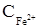 зменшується, а концентрація тривалентного заліза збільшується. Тобто, з'являється окисно-відновна електрохімічно зворотна пара,
зменшується, а концентрація тривалентного заліза збільшується. Тобто, з'являється окисно-відновна електрохімічно зворотна пара, 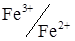 , концентрація якої росте. Якщо відтитровано, наприклад 10% двовалентного заліза, то з'явиться 10% Fe3+ і залишиться 90% Fe2+. Швидкість електролізу лімітується швидкістю транспортування іонів до електрода, швидкістю дифузії, що пропорційна інгредієнту концентрацій. У нашому прикладі, коли Fe3+ менше ніж Fe2+, швидкість електролізу і сила струму в ланцюзі лімітується концентрацією тривалентного заліза. В міру титрування кількість заліза (III) зростає і струм збільшується. Максимальне значення сили струму досягається в той момент, коли відтитровано 50% заліза (II) (рис. 6.17). Надалі концентрація Fe2+, що залишилась стає менше, ніж утворилося Fe3+ і лімітуючим швидкість електролізу стає двовалентне залізо. Струм зменшується. Коли все Fe2+ відтитровано біхроматом калію, зворотна пара зникає і струм знову практично дорівнює нулю.
, концентрація якої росте. Якщо відтитровано, наприклад 10% двовалентного заліза, то з'явиться 10% Fe3+ і залишиться 90% Fe2+. Швидкість електролізу лімітується швидкістю транспортування іонів до електрода, швидкістю дифузії, що пропорційна інгредієнту концентрацій. У нашому прикладі, коли Fe3+ менше ніж Fe2+, швидкість електролізу і сила струму в ланцюзі лімітується концентрацією тривалентного заліза. В міру титрування кількість заліза (III) зростає і струм збільшується. Максимальне значення сили струму досягається в той момент, коли відтитровано 50% заліза (II) (рис. 6.17). Надалі концентрація Fe2+, що залишилась стає менше, ніж утворилося Fe3+ і лімітуючим швидкість електролізу стає двовалентне залізо. Струм зменшується. Коли все Fe2+ відтитровано біхроматом калію, зворотна пара зникає і струм знову практично дорівнює нулю.

Рис. 6.17. Схематичні вольтамперні криві для різного ступеня відтитрованості Fe2+ біхроматом калію і крива титрування з двома індикаторними електродами
Крива титрування має вигляд симетричного дзвону («горба») (рис. 6.17).
До електрохімічно зворотних сполучених пар крім 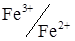 відносяться
відносяться  і деякі інші.
і деякі інші.
Практично титрування з двома індикаторними електродами можливе в будь-якому випадку, якщо прикладена напруга перевищує різницю катодного й анодного потенціалів, що встановлюються в умовах даного титрування. При виборі напруги знімають вольтамперні криві всіх «учасників» титрування, а іноді і всіх інших іонів, що є присутніми у розчині. Якщо для вибору потенціалу індикаторного електрода при звичайному амперометричному титруванні граничного струму катодного або анодного процесу (ділянки 1 і 2 на кривій рис. 6.18), то для вибору напруги при титруванні з двома індикаторними електродами важлива ділянка, що збігається з віссю абсцис (ділянка 3 на кривій рис. 6.18). Чим більше зворотність, тим менше довжина цієї ділянки і тим менше може бути прикладена напруга для того, щоб забезпечити катодний і анодний процеси на електродах. Накладена на електроди напруга постійна, але потенціали анода і катода в більшому або меншому ступені змінюються під час титрування. У випадку появи нової зворотної пари електродів змінюються досить рідко зі збереженням, що накладається, DЕ.

Рис. 6.18. Схематична вольамперна крива для необоротної окислювально-відновної пари (1). Форма кривих амперометричного титрування IrIV+RSH (2), K4Fe(CN)6+KMnО4 (3), Zn2++K4Fe(CN)6, (K3Fe(CN)6), Cu2++RSH на фоні KCl (5)
Якщо розглянути форми кривих амперометричного титрування з двома індикаторними електродами, їх можна розділити на такі типи в залежності від електрохімічних властивостей компонентів:
– титрування іонів, що утворюють у результаті окисно-відновної хімічної реакції в розчині зворотну пару, незворотною – колоколоподібні криві (рис. 6.17 і рис. 6.18, кр. 3);
– титрування електрохімічної незворотної пари – зворотною (зворотна пара з'являється після точки еквівалентності – ель-подібна крива (рис. 6.18, кр. 4);
– титрування зворотної пари – зворотною. Наприклад, йод-фероціанідом:
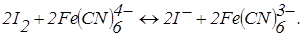
До точки еквівалентності «працює» пари 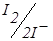 , що з'являється при додаванні першої порції титранту. Після точки еквівалентності в розчині накопичується K3Fe(CN)6 і з’являються надлишкові краплі K4Fe(CN)6. Виникає нова зворотна пара. Струм знову збільшується (рис. 6.18, кр. 2). Таким чином електродні реакції під час титрування можна записати так:
, що з'являється при додаванні першої порції титранту. Після точки еквівалентності в розчині накопичується K3Fe(CN)6 і з’являються надлишкові краплі K4Fe(CN)6. Виникає нова зворотна пара. Струм знову збільшується (рис. 6.18, кр. 2). Таким чином електродні реакції під час титрування можна записати так:
до точки еквівалентності:
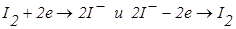 ,
,
після точки еквівалентності:
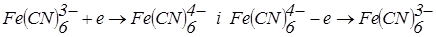 .
.
При проходженні в розчині реакцій осадження можливо штучне створення зворотної пари. Так для визначення цинку (II) фероціанідом у розчин перед титруванням додають декілька крапель розведеного розчину K3Fe(CN)6. Тоді після повного осадження цинку (II):
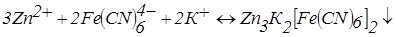
з'явиться надлишок K4Fe(CN)6 і внаслідок «роботи» пари 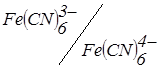 струм зростає.
струм зростає.
Для амперометричного титрування з двома індикаторними електродами використовують і сірковмісні органічні сполуки. Використання останніх значно розширило можливість застосування амперометричного титрування з двома індикаторними електродами.
Більшість сірковмісних реагентів диетілдитіокарбамінат, 8-меркаптохінолін та ін., утворюють у водних розчинах «змішані» електрохімічно зворотні пари О2 розчинні у Н2О/RSH (рис. 19, кр. 1). Системи 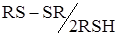 електрохімічно не зворотні. Змішаними електрохімічно зворотними парами називаються системи, утворені з компонентів різної природи, у яких потенціал відновлення однієї речовини збігається з потенціалом окиснювання іншої.
електрохімічно не зворотні. Змішаними електрохімічно зворотними парами називаються системи, утворені з компонентів різної природи, у яких потенціал відновлення однієї речовини збігається з потенціалом окиснювання іншої.

Рис. 6.19. Анодно-катодна хвиля “змішаної” пари О2/RSH (1), криві амперометричного титрування Ni2+ (Cd2+, Zn2+) розчином RSH (2), послідовне титрування срібла (I) і міді (II), Au3++Pd2+IrIV (4) 8-меркаптохіноліном
У розчинах, що містять кілька компонентів, як уже відзначалося, із сірковмісними компонентами можуть послідовно проходити реакції осадження і комплексоутворення. Таке сполучення можливе і для одного метало-іона перемінного ступеня окиснювання. Так при титруванні міді (II) на фоні KCl спочатку проходить відновлення міді (II) до одновалентної, а потім осадження різнолігандної малорозчинної сполуки
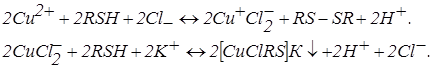
Крива такого титрування наведена на рис. 18, кр. 5.
На двох індикаторних електродах можливі так само послідовні титрування, наприклад срібла (AgCl2–) і міді (II) на фоні KCl. Початку реакції з міддю відповідає різка зміна струму в зв'язку з появою зворотної сполученої пари 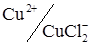 (рис. 6.19, кр. 3).
(рис. 6.19, кр. 3).
Приклади титрування трикомпонентної композиції наведені на рис. 19, кр 4. У розчині з 8-меркаптохіноліном послідовно взаємодіє золото (III), паладій (II) і іридій (IV). Високий струм спочатку титрування обумовлюється наявністю зворотної змішаної пари 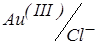 . В міру зменшення концентрації Au3+, струм зменшується, а CCl– практично залишається постійним.
. В міру зменшення концентрації Au3+, струм зменшується, а CCl– практично залишається постійним.
Читайте також:
- Амперометричне визначення свинцю розчином ДДТК
- Амперометричне титрування
- Біметалізм є системою, де роль загального еквівалентна законодавча закріплюється на рівних правах за двома благородними металами – золотом і сріблом.
- Броматометрія, зворотне титрування, з йодометричним закінченням
- Вибір індикатора . Криві титрування
- Визначення кінця титрування
- Вирішити дану проблему у бюджетуванні можна двома основними способами.
- Виробнича функція з двома змінними факторами
- Виробнича функція з двома змінними факторами
- Витрати та надходження за двома інвестиційними проектами
- Вільні коливання систем з двома ступенями свободи
| <== попередня сторінка | | | наступна сторінка ==> |
| ПОСЛІДОВНІ (ДИФЕРЕНЦІЙОВАНІ) ТИТРУВАННЯ | | | ПРИКЛАДИ ВИЗНАЧЕННЯ РЕЧОВИН АМПЕРОМЕТРИЧНИМ ТИТРУВАННЯМ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |