
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Електронні формули
Розподіл електронів в атомі на енергетичних рівнях і підрівнях зображують у вигляді електронних формул. Покажемо, як їх скласти.
Кожний електрон в атомі займає вільну орбіталь з найнижчою енергією, що відповідає найсильнішому зв'язку електрона з ядром,— принцип найменшої енергії. Із збільшенням порядкового номера елемента електрони заповнюють орбіталі і рівні в порядку зростання їхніх енергій: рівні заповнюються від першого до сьомого, а підрівні — в послідовності s — р — d — f. Послідовність зростання енергії визначена дослідним шляхом. Вона називається шкалою енергії. Відповідно до неї складається ряд послідовного заповнення електронами орбіталей aтомів елементів періодичної системи. Цей ряд, в якому вертикальними лініями відокремлейі періоди, позначені зверху римськими цифрами, має вигляд
І II III IV V VI VII
1s | 2s, 2р | 3s, 3р | 4s, 3d, 4р | 5s, 4d, 5р | 6s, 4f, 5d, 6р | 7s, 5f, 6d, 7р
Орбіталь з мінімальною енергією — це 1s-орбіталь. В атома Гідрогену її займає єдиний електрон атома. Тому електронна формула, або електронна конфігурація, атома Гідрогену має вигляд 1s1.
Оскільки на одній орбіталі можуть міститися два лектрони, то обидва електрони атома Гелію розміщуються на 1s-орбіталі. Отже, електронна формула Гелію 1s2. Електронна оболонка не завершена і дуже стійка, це благородний газ.
В елементів II періоду заповнюється L-рівень (n=2), причому спочатку орбіталь s-підрівня, а потім три орбіталі р-підрівня. Третій електрон в атомі 3Lі займає 2s-орбіталь. Електронна формула Lі: 1s22s1. Електрон 2s1 зв'язаний з ядром атома значно слабкіше, ніж 1s-електрони, тому атом Літію може легко втрачати його, утворюючи йон Li+.
В атомі 4Ве четвертий електрон також розміщений на 2s-орбіталі: 1s22s2. Легше ніж інші електрони, у Ве відриваються 2s-електрони з утворенням йона Ве2+.
Оскільки 2s-орбіталь заповнена, то п'ятий електрон в атома 5В займає 2р-орбіталь. Електронна формула атома Бору: 1s22s22р1.
Далі в атомів С, N, О, F заповнюються 2p-орбіталі, закінчується заповнення в атома Ne. Запишемо їх електронні формули:
6С 1s22s22р2, 7N 1s22s22р3, 8О 1s22s22р4, 9F 1s22s22р5, 10Nе 1s22s22р6.
Починаючи з елементів III періоду, в атомів заповнюється третій М-рівень, який складається з 3s-, 3р- і 3d-підрівнів. Наприклад:
11Na 1s22s22р63s1, 17Сl 1s22s22р63s23р5.
Інколи у формулах, які зображують розподіл електронів у атомах, зазначають тільки число електронів на кожному енергетичному рівні. Тоді їх записують так:
11Na — 2 ∙ 8 ∙ 1, 17Сl — 2 ∙ 8 ∙ 7.
Під час написання електронних формул слід ураховувати так зване «проскакування» електрона. Так, електронна формула Хрому повинна бути 1s22s22р63s23р63d44s2. Однак на зовнішньому рівні в атома Хрому не два електрони, а один — другий електрон «проскочив» на d-підрівень другого ззовні рівня. У цьому випадку розташування електронів в атома Хрому таке: 1s22s22р63s23р63d54s1. Це ж саме спостерігається для Nb, Мо та інших елементів. У Рd електрони на рівнях розміщуються так: 2.8.18.18.0 (тут п'ятого енергетичного рівня взагалі немає — обидва електрони «проскочили» на сусідній рівень).
Дуже часто структуру електронних оболонок зображують за допомогою енергетичних, або квантових, комірок — це так звані графічні електронні формули. Кожна така комірка позначається клітиною: клітина — орбіталь, стрілка — електрон, напрям стрілки — напрямленість спіну, вільна клітина — вільна орбіталь, яку може займати електрон під час збудження. Згідно з принципом Паулі, в комірці може перебувати один або два електрони (якщо два електрони, то вони спарені).
Як приклад напишемо схему розподілу електронів у квантових комірках для атома:
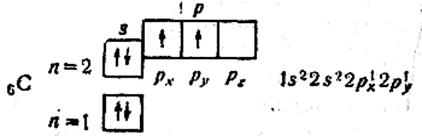
Орбіталі підрівня заповнюються так; спочатку по одному електрону з однаковими спінами, а далі по другому електрону з протилежними спінами. Оскільки на 2р-підрівні три орбіталі з однаковою енергією, то кожний з двох 2р-електронів займає по одній орбіталі (наприклад, pх і pу). Одна орбіталь залишається вільною (pz). В атомі Карбону два неспарених електрони. Справа від схеми в електронній формулі подано більш детальний запис, в якому вказано розподіл електронів на pх і pу-орбіталях. Такий запис теж часто застосовують.
В атомі Нітрогену всі три 2р-орбіталі (pх, pу, pz) зайняті поодинокими електронами:
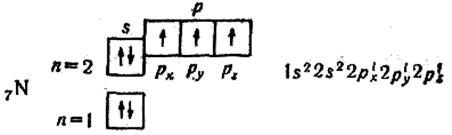
Отже, у нього три неспарених електрони. Це відображено і в детальній електронній формулі (справа від схеми).
Починаючи з атома Оксигену, 2р-орбіталі заповнюються другим електроном з протилежним спіном:
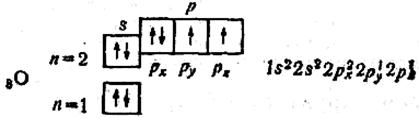
В атомі Оксигену два неспарених електрони. В атомі Флуору — один неспарений електрон:
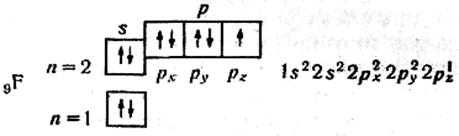
Отже, розподіляючи електрони по квантових комірках, можна виявити число неспарених електронів в атомі. В атомі Nе завершується заповнення другого рівня:
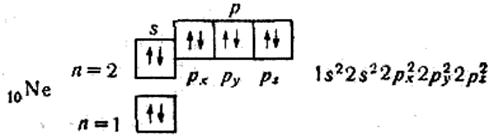
Вісім зовнішніх електронів (s2р6) утворюють дуже стійку структуру з чотирьох двохелектронних хмар. Усі електрони в атомі Неону спарені. Неон — благородний газ.
Читайте також:
- Аналогові обчислювальні електронні машини.
- Багатоелектронні атоми.
- Безпосереднє обчислення з використанням формули Ньютона-Лейбніца.
- Бюлетені та інші інформаційні матеріали, електронні видання
- Введення формули в комірку.
- Виведення формул для знаходження площі паралелограма, трикутника, трапеції. Формули для знаходження площ поверхонь просторових геометричних фігур.
- Виникнення, суть і функції грошей. Особливості функціонування паперових грошей за сучасних умов. Роль золота. «Електронні гроші».
- Вітальні формули
- Друковані та електронні джерела знань для викладання психології.
- Електронні (інтернет) мас-медіа
- Електронні аналогові та цифрові вольтметри та амперметри
- Електронні бібліотеки
| <== попередня сторінка | | | наступна сторінка ==> |
| Характеристика орбіталей | | | Властивості та енергетичні характеристики атомів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |