
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Характеристика орбіталей
Якщо йдеться про ту частину електронної хмари (орбіталі), де її густина найбільша, то можна говорити про її розмір і форму. Так, залежно від величини енергії електронні хмари розрізняються за розмірами. Чим сильніше притягається електрон до ядра, тим його хмара (орбіталь) менша за розміром, але щільніша.
Орбіталі (електронні хмари) розрізняються не лише за розмірами, а й за формою. Так, єдиний електрон в атомі Гідрогену, рухаючись навколо ядра, утворює електронну хмару сферичної форми. Орбіталі, що мають форму кулі (сфери), позначають буквою s, а електрони, орбіталі яких мають сферичну форму, називають s-електронами (рис. 2).

Рис. 2. Форма s- і p-орбіталей
Проте орбіталі (електронні хмари) можуть мати форму гантелі (об’ємної «вісімки») або ще складнішу.
Орбіталі, що мають форму гантелі, позначають буквою р, а електрони, орбіталі яких мають гантелеподібну форму, називають р-електронами.
Центри орбіталей збігаються з центром ядра.
р-орбіталі відрізняються одна від одної розміщенням у просторі: вони розміщуються вздовж трьох взаємно перпендикулярних осей координат (рис. 3). Орбіталі складніших форм позначаються буквами d, f та ін.
Електронні хмари різних форм відрізняються між собою ще й силою притягання до ядра. Так, s-електрони, орбіталі яких мають сферичну форму, притягаються до ядра сильніше, ніж р-електрони, орбіталі яких мають форму гантелі, а електрони з іще складнішими формами орбіталей притягаються ще слабкіше.

Рис. 3.Схема взаємного розміщення р-орбіталей у просторі
Загальне число електронів у атомі відповідає протонному числу, тобто порядковому номеру елемента, й утворює його електронну оболонку.
Електрони цієї оболонки мають різний запас енергії, тому одні з них сильніше притягуються до ядра і розміщуються ближче до нього, інші —слабкіше притягуються і розміщуються далі від ядра, тобто положення кожного електрона в атомі відповідає його енергетичному стану. Ось чому електрони розміщуються навколо ядра шарами — так званими електронними шарами (енергетичними рівнями).

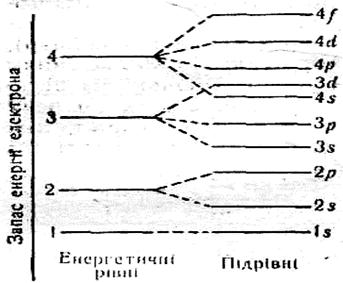
 Кожний електронний шар (енергетичний рівень) складається з певної кількості орбіталей (енергетичних підрівнів) певної форми. Так, перший шар складається з орбіталі одного типу — однієї s–орбіталі (s–підрівня). Другий шар — з орбіталей двох типів — s і р (s- і р-підрівнів). Третій шар — з орбіталей трьох типів — s, р і d (s-, р- і d-підрівнів). Виходить, який номер шару, стільки є форм орбіталей, що його утворюють. Проте число орбіталей на кожному шарі різне, воно дорівнює n2, де n — номер шару. Так, на першому шарі (n = 1) одна орбіталь, на другому (n = 2) — чотири, на третьому (n = 3) — дев’ять і т. д.
Кожний електронний шар (енергетичний рівень) складається з певної кількості орбіталей (енергетичних підрівнів) певної форми. Так, перший шар складається з орбіталі одного типу — однієї s–орбіталі (s–підрівня). Другий шар — з орбіталей двох типів — s і р (s- і р-підрівнів). Третій шар — з орбіталей трьох типів — s, р і d (s-, р- і d-підрівнів). Виходить, який номер шару, стільки є форм орбіталей, що його утворюють. Проте число орбіталей на кожному шарі різне, воно дорівнює n2, де n — номер шару. Так, на першому шарі (n = 1) одна орбіталь, на другому (n = 2) — чотири, на третьому (n = 3) — дев’ять і т. д.
Орбіталі різні за формою, і на кожній із них може перебувати не більш ніж два електрони, а значить, загальне число електронів певного електронного шару дорівнює 2n2, де n — номер шару.
Отже,
1–й шар складається з однієї s–орбіталі;
2–й шар складається з однієї s–орбіталі і трьох р–орбіталей;
3–й шар складається з однієї s–орбіталі, трьох р–орбіталей і п'яти d–орбіталей.
Знаючи будову електронних шарів, можна уявити структуру всієї електронної оболонки атома. Для цього необхідно знати правила заповнення електронами вільних орбіталей. Ці правила подано нижче.
1. Електрони заповнюють електронні шари у порядку послаблення притягання їх до ядра (від 1–го до наступних).
 2. Заповнення електронами орбіталей кожного шару відбувається також у порядку послаблення зв’язку з ядром: спочатку заповнюються s–орбіталі, потім р–орбіталі, далі наступні.
2. Заповнення електронами орбіталей кожного шару відбувається також у порядку послаблення зв’язку з ядром: спочатку заповнюються s–орбіталі, потім р–орбіталі, далі наступні.
3. На кожній орбіталі може перебувати не більш ніж два електрони.
4. Електрони заповнюють орбіталі спочатку по одному, а якщо електронів більше за число орбіталей — то по два, тоді утворюються електронні пари.
Нижче подано схему поділу електронних шарів (енергетичних рівнів) на орбіталі (підрівні).
Читайте також:
- I. Загальна характеристика політичної та правової думки античної Греції.
- II. ВИРОБНИЧА ХАРАКТЕРИСТИКА ПРОФЕСІЇ
- II. Морфофункціональна характеристика відділів головного мозку
- Аварії на хімічно-небезпечних об’єктах та характеристика зон хімічного зараження.
- Автобіографія. Резюме. Характеристика. Рекомендаційний лист
- Автокореляційна характеристика системи
- Амплітудно-частотна характеристика, смуга пропускання і загасання
- Аплікація як вид образотворчої діяльності дошкільнят, його характеристика.
- Архітектура СЕП та характеристика АРМ-1, АРМ-2, АРМ-3
- Афіксальні морфеми. Загальна характеристика
- Банківська система України і її характеристика
- Банківські ризики та їх характеристика
| <== попередня сторінка | | | наступна сторінка ==> |
| Сучасна модель стану електрона в атомі | | | Електронні формули |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |