
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Основні поняття, визначення, формули.
Хімічна кінетика. Вплив температури та каталізаторів на швидкість шімічних
Фотохімічні
Ланцюгові
ІІ. Складні
Псевдомономолекулярні
І. Прості
Класифікація хімічних реакцій
Усі хімічні реакції можна класифікувати наступним чином:
1. Одномолекулярні: A → B; A → B + C
2. Двомолекулярні: A + B → C; 2A → B
3. Тримолекулярні: A + 2B → C; 3A → B
1. Паралельні C ← A → B
2. Оборотні A ↔B
3. Спряжені A + B → F, A + C → D
4. Послідовні A → B → C
Вплив температури на швидкість хімічних реакцій визначається емпіричним правилом Вант-Гоффа: при збільшені температури на 10°С швидкість хімічної реакції зростає в два-чотири рази.
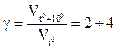 g - температурний коефіцієнт реакції
g - температурний коефіцієнт реакції
Зауважимо, що правило Вант-Гоффа справедливе для відносно невеликого інтервалу температур (273-373 К).
Для біохімічних реакцій g = 1,6—3. Більшість ферментів виявляє каталітичну активність в інтервалі температур 10 - 60°С.
Якщо при захворюванні температура тіла людини підвищилась, наприклад, від 36,5 до 39,5°С, то це свідчить про збільшення швидкості біохімічних процесів у 1,13-1,39 рази. Ще більше підвищення температури (40-42°С) призводить до швидкого зниження біохімічного процесу у зв’язку з денатурацією та інактивацією ферментів.
Ферментативні процеси характеризуються більш високими температурними коефіцієнтами (7-10). У цьому випадку інтервал в 100C надто широкий. Тому потрібно брати більш вузький інтервал температур (2, 3, 50С), крім того, при різних інтервалах температур коефіцієнт не є постійним.
Взагалі, швидкість хімічної реакції при підвищенні температури визначається формулою:
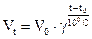
Зростання швидкості хімічних реакцій з підвищенням температури пояснюється тим, що в реакцію вступають тільки ті частинки, які мають достатню для цього енергію - енергію активації (Еа). З збільшенням температури число таких частинок зростає, тому і збільшується швидкість хімічних реакцій. Енергію активації можна надати частинками хвильовим способом (звук, проміння) або наданням системі тепла (підвищенням температури). Енергія активації витрачається на розрив зв’язків у вихідних речовинах і на достатнє для проходження реакції зближення частинок.

Для перебігу реакції молекули реагентів повинні набути критичного (порогового) значення енергії, що перевищує середню енергію молекул. Це означає, що на шляху кожної хімічної реакції стоїть енергетичний бар’єр, подолати який може тільки незначна частина реагуючих молекул, які при даній температурі мають для цього достатню енергію.
Енергія активації дорівнює різниці між мінімальним надлишком енергії, необхідним для хімічної взаємодії і середнім запасом енергії молекул.
У 1889 році С.Арреніус запропонував рівняння для визначення енергії активації
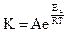
де,
К - константа швидкості хімічної реакції;
А - передекспоненційний множник (враховує просторову будову реагуючих частинок, їх можливі розміщення під час зіткнень;
е - основа натуральних логарифмів;
Еа - енергія активації;
R - універсальна газова постійна;
Т - абсолютна температура.
Розмірність [Еа] = [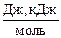 ]
]
Логарифмуємо рівняння Арреніуса і одержимо:

Визначаємо К при різних температурах і знаходимо А.
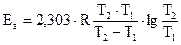
Енергія активації для більшості процесів змінюється у межах від 40 до 250 кДж/моль.
Коли Еа < 20 кДж/моль. то реакції проходять при температурі до 500С; коли Еа > 120 кДж/моль - 250°С.
Залежність швидкості хімічної реакції від концентрації та темперватури пояснюють дві теорії: активних зіткнень і перехідного стану. Перша використовує основні положення молекулярно-кінетичної теорії та припущення про існування енергетичного бар’єру. Для розрахунку швидкості реакції необхідно знати кількість зіткнень молекул за одиницю часу в одиниці об’єму і частку зіткнень, які призводить до взаємодії реагентів. Добуток цих двох величин становить кількість молекул, що прореагували ва одиницю часу в одиниці об’єму, тобто швидкість хімічної реакції.
Однак швидкість реакції, розрахована теоретично, не завжди співпадає зі швидкістю, визначеною експериментально. Виявляється що для перебігу реакції молекулам потрібна не тільки енергія (Еа), а й певна просторова орієнтація під час зіткнення. Цей стеричний фактор не може розрахувати теорія активних зіткнень.
Теорія перехідного стану складається з двох положень.
1. Кожна хімічна реакція відбувається через утворення активованого комплексу, який потім розпадається на продукти даної реакції.
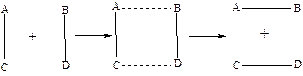
Перехідний стан - комплекс, в якому одночасно відбувається розрив старих і утворення нових хімічних зв’язків. Для його утворення необхідна енергія. Додаткову енергію, яка необхідна для переходу системи в вихідного стану в активований комплекс, називають енергією активації.
2. Другим положенням теорії перехідного стану є рівновага активованого комплексу з вихідними речовинами.
Читайте також:
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- Адвокатура в Україні: основні завдання і функції
- Адміністративний проступок: поняття, ознаки, види.
- Адміністративні провадження: поняття, класифікація, стадії
- Акти застосування юридичних норм: поняття, ознаки, види.
- Амортизація основних засобів, основні методи амортизації
- Артеріальний пульс, основні параметри
- АРХІВНЕ ОПИСУВАННЯ: ПОНЯТТЯ, ВИДИ, ПРИНЦИПИ І МЕТОДИ
- Банківська система та її основні функції
- Банківський контроль та нагляд: форми та мета здійснення. Пруденційний нагляд: поняття, органи та мета проведення.
- Бібліографія, поняття, види, методи
- Біржові товари і основні види товарних бірж. Принципи товарних бірж.
| <== попередня сторінка | | | наступна сторінка ==> |
| Хімічна кінетика. Вплив природи і концентації реагуючих речовин на швидкість реакцій. | | | Каталітичні процеси. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |