
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Кінетика процесу абсорбції
Вступ
АБС0РБЦІЯ
Абсорбція - це поглинання газів або парів з газових або парових сумішей рідкими поглиначами, що називаються абсорбентами. Зворотній процес виділення рідкого поглинача з суміші газів називають десорбцією. Десорбцію газів проводять відгонкою його в струмі інертного газу або водяного пару в умовах підігріву абсорбенту або зниження тиску над абсорбентом.
В промисловості абсорбцію використовують для вирішення наступних основних задач:
1) для отримання готового продукту - (наприклад, абсорбція SO3 в виробництві сірчаної кислоти, абсорбція HCL з отриманням хлороводневої кислоти, абсорбція оксидів азоту водою в виробництві азотної кислоти і т.д.); при цьому абсорбцію проводять без десорбції;
для виділення цінних компонентів з газових сумішей (наприклад, абсорбція бензолу з коксового газу; абсорбція ацетилену з газів крекінга або піроліза природного газу і т.д.); при цьому абсорбцію проводять з десорбцією;
для очистки газових викидів від шкідливих домішок (наприклад, очистка топочних газів від SO2, очистка від фтористих з'єднань газів, що виділяються при виробництві мінеральних добрив і т.д.). очистку газів від шкідливих домішок адсорбцією використовують також для технологічних газів, коли присутність домішок неприпустима для подальшої переробки газу (наприклад, очистка коксового і нафтового газів від H2S, очистка азотоводневої суміші для синтезу аміаку від СО2 і CO і т.д.). В цих випадках вилучаємі з газових сумішей компоненти звичайно використовують, тому їх виділяють десорбцією;
для суміші газів, коли в абсорбційних процесах (абсорбція десорбція) приймають участь дві фази - рідка і газова - і відбувається перехід речовини з газової фази в рідку (при абсорбції) або навпаки, з рідкої в газову (при десорбції), причому інертний газ і поглинач є лише носіями компонента відповідно в газовій і рідкій фазах в цьому смислі в масопереносі участі не приймають.
Апарати, в котрих проводять процеси абсорбції, називають абсорберами.
9.1 Рівновага в процесах абсорбції
Умовою рівноваги між газовою і рідкою фазами є рівновага температур і тиск обох фаз і рівність хімічних потенціалів для всіх компонентів в обох фазах.
При постійній температурі і тиску в фазах хімічний потенціал компонента , що розподіляється, пропорційний концентраціям його в фазах. Тому в стані рівноваги між концентраціями компонента , що розподіляється, в обох фазах встановлюється деяке співвідношення, що характеризується константою фазової рівноваги, котра рівна відношенню концентрації компонента , що розподіляється, в газовій фазі до його концентрації в рідкій фазі.
В загальному випадку константа фазової рівноваги залежить від тиску (Р), температури (Т) і концентрації компонента , що розподіляється, (х) в рідині: m=f(P,T,x)
Ця функція для деяких систем може бути розрахована, але в більшості випадків її знаходять дослідним шляхом.
В якості основного закону, що характеризує рівновагу в системах газ-рідина, звичайно використовують закон розчинності газів в рідинах, сформульований Генрі. Згідно до цього закону при банній температурі мольна доля газу в розчині (розчинність) пропорційна парціальному тиску газу над розчином:
х = р/Е (9.1.1)
або
p = Ex (91.2)
де p - парціальний тиск газу над розчином в мм рт. ст.; х - концентрація газу в розчині в мольних долях; Е - коефіцієнт пропорційності (коефіцієнт Генрі) в мм рт.ст..
Значення р і х, що задовольняють рівняння (9.1.2), мають місце при досяганні рівноваги між фазами; ці значення потрібно розглядати як рівноважні: р - парціальний тиск газу, що знаходиться в рівновазі з розчином, що має концентрацію х, або х - концентрація газу в розчині, що знаходиться в рівновазі з газом, в котрому парціальний тиск газу, що розглядається, дорівнює р.
Коефіцієнт Е залежить від природи речовини, що розчиняться, і температури:
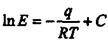 (9.1.3)
(9.1.3)
Де q - теплота розчинення газу в ккал/кмоль, R=1,987 ккал/кмоль·град. - універсальна газова постійна ; Т - абсолютна температура розчинення в К; С - постійна, що залежить від природи газу і рідини і визначається дослідним шляхом. З рівняння (9.1.3) і рис.9.1.1 видно, що з ростом температури розчинність газів в рідинах зменшується.
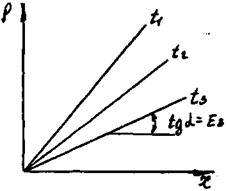
Рис.9.1.1. Залежність між розчинністю газу в рідині і парціальним тиском його над розчином при різних температурах t1>t2>t3 і відповідно Е1>Е2>Е3.
При розчиненні газу в рідині температура останньої звичайно збільшується внаслідок виділення значної кількості тепла.
Кількість тепла, що виділяється при. абсорбції, може бути знайдено як
Qаб =qдL(x1 - x2) (9.1.4)
де - qд - диференціальна теплота розчинення в межах зміни концентрації х1 - х2, ккал/кг; L - кількість абсорбенту, кг.
Якщо абсорбція проходить без відводу тепла, то можна допустити, що все тепло яке виділяється йде на нагрів рідини і температура останньої збільшується на величину
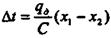 (9.1.5)
(9.1.5)
де С - теплоємність розчину, ккал/(кг·град).
Парціальний тиск газу, що розчиняється, в газовій фазі, відповідаючий рівновазі, може бути замінений рівноважною концентрацією. Згідно закону Дальтона парціальний тиск компонента в газовій суміші дорівнює загальному тиску, помноженому на мольну долю цього компонента в суміші, тобто
р = Ру і у = р/Р, де Р - загальний тиск газової суміші;
у- концентрація газу, що розподіляється, в суміші в мольних долях. Співставляючи останню рівність з рівнянням (9.1.2), знайдемо
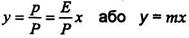 (9.1.6)
(9.1.6)
де m = Е/Р - константа фазової рівноваги
Рівняння (9.1.6) виражає залежність між рівноважними концентраціями газу, що розподіляється, в газовій і рідкій фазах. Якщо замінити в цьому рівнянні концентрації х і у, виражені в мольних долях, на X і У, виражені в відносних мольних долях, то, маючи на увазі співвідношення
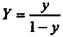 ,
,  ,
,  ,
, 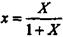
рівняння (9.1.6) можна переписати як:
 (9.1.7)
(9.1.7)
При незначних концентраціях X величина (1-т)Х ≈ 0 і рівняння (9.1.7) набуває більш простого вигляду:
Y=mХ (9.1.8)
тобто при низьких концентраціях закон Генрі зображується прямою лінією.
Для добре розчинних газів, при великих концентраціях, розчинність менше, ніж випливає з закону Генрі.
Для систем, що не підпорядковуються цьому закону, коефіцієнт т в рівнянні (9.1.7) є змінною величиною, лінія рівноваги являє собою криву, котру звичайно будують по дослідним даним.
Якщо розчин є ідеальним і лише в газовій фазі спостерігається відхилення від ідеального стану, то в цьому випадку компоненти розчину не діють один на одного, Тому концентрація даного компонента в газовій фазі залежить лише від концентрації його в рідині (при постійній температурі і тиску). Тоді до кожного компоненту і можливо використовувати рівняння (9.1.8):
Yi = mXi , (9.1.9)
в котрому константа фазової рівноваги т залежить лише від температури і загального тиску в системі.
Тому, при постійній температурі рівновага даного компоненту і в розбавленому розчині на діаграмі У - X представляється прямою лінією з нахилом, тангенс котрого дорівнює mi.
Механізм абсорбції - це молекулярна та конвективна дифузії. Основне рівняння абсорбції має наступний вигляд:
My=Ky·ΔY·F, (9.2.1)
Mx=Kx·ΔX·F, (9.2.2)
де Ку - коефіцієнт масопередачі або абсорбції
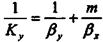 . (9.2.3)
. (9.2.3)
де 1/Ку - опір абсорбції;
1/βy - опір в фазі G;
m/βχ - опір в фазі L.
В абсорбції при дуже малих т, тобто добре розчинних газів величина т/βх дуже мала, тобто опором в рідкій фазі можна знехтувати.
Для погано розчинних газів можна знехтувати опором газової фази, тоді Ky≈βy, Ky≈βx/m, Ky≈βx (9.2.4)
При хімічній реакції є вплив на кінетику та рівновагу процесу. Чим вище швидкість реакції, тим вище швидкість абсорбції, цього можна досягти збільшуючи коефіцієнт βх. В цьому випадку рівняння масопередачі може бути записане:
М = β'Х ·ΔХ·Т
де β'χ = ǽ·βχ - коефіцієнт масовіддачі в рідкій фазі при абсорбції.
ǽ - коефіцієнт прискорення абсорбції при протіканні хімічної реакції.
Читайте також:
- A) правові і процесуальні основи судово-медичної експертизи
- H) інноваційний менеджмент – це сукупність організаційно-економічних методів управління всіма стадіями інноваційного процесу.
- II. Поняття соціального процесу.
- IV. План навчального процесу.
- А. Особливості диференціації навчального процесу в школах США
- Автоматизація процесу призначення IP-адрес
- Адміністративний примус застосовують на основі адміністративно-процесуальних норм.
- Активний та пасивний типи адаптаційного процесу.
- Альтернативні парадигми організаційного процесу
- Аналіз процесу і продуктів діяльності.
- Аналіз процесу формування маркетингових комунікацій
- Аналіз стану та проблем реалізації Болонського процесу в Україні за ключовими напрямками.
Переглядів: 1219
| <== попередня сторінка | | | наступна сторінка ==> |
| Розрахунок висоти апаратів | | | Матеріальний баланс і витрата абсорбенту |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |