
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Рівновага в масообміних процесах
Рівновага – це такий стан, при якому швидкість прямого і оберненого процесу вирівнюються і не відбувається зміна концентрацій x i y в І і ІІ
фазах.
Рівновага визначається дослідним шляхом і описується залежністю .
.
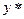 – означає рівноважну концентрацію по відношенню до х.
– означає рівноважну концентрацію по відношенню до х.
Якщо концентрації невеликі рівноважна залежність має лінійний характер 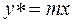 ,
,
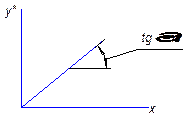
m – коефіцієнт (tgα) називають коефіцієнтом розподілу. Це рівняння можна застосувати навпаки і визначити 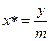 .
.
Приклад: розглянемо абсорбцію аміаку з повітря водою.
 Схематично Фy(газова фаза)_____________ границя
Схематично Фy(газова фаза)_____________ границя


 Фх(рідка фаза) розподілу
Фх(рідка фаза) розподілу
 – це масова концентрація
– це масова концентрація  аміаку у повітрі
аміаку у повітрі
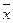 – масова концентрація
– масова концентрація 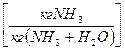 аміаку у воді
аміаку у воді
якщо  >
> *, тобто робоча концентрація більша за рівноважну, то процес буде іти в сторону досягнення рівноваги і у буде зменшуватися, а х – зростати. Схематично це зображуємо як напрямок стрілок з фази Фу у фазу Фх .
*, тобто робоча концентрація більша за рівноважну, то процес буде іти в сторону досягнення рівноваги і у буде зменшуватися, а х – зростати. Схематично це зображуємо як напрямок стрілок з фази Фу у фазу Фх .
Якщо розглядати граничну концентрацію газу в рідині (її означають як розчинність), то позначення її буде 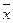 *.
*.
Рівновага підпорядковується правилу фаз – (Гібса):
| Ф+С=К+2 |
Ф- кількість фаз, С- кількість компонентів, К- кількість степенів вільності, що описують умови рівноваги.
Розглянемо як приклад процес абсорбції NH3
Ф=2 (рідина і газ); К=3 (NH3, H2O і повітря); С=К+2-Ф=3+2-2=3; (незалежні t0, P і одна з концентрацій, наприклад х). Тоді у*=f(x,P,t0), а коли будуємо графічну залежність у*=f(x) витримуємо t=const, Р=const

Змінюючи t i P змінюється положення лінії рівноваги, а в подальшому рушійну силу як різницю між робочою і рівноважною концентраціями.
Читайте також:
- Баланс сил і рівновага в МС
- Взаємодія попиту і пропозиції та ринкова рівновага.
- Взаємодія попиту і пропозиції. Ринкова рівновага.
- Взаємодія попиту й пропозиції. Ринкова рівновага
- Взаємодія попиту та пропозиції. Ринкова рівновага
- Взаємодія попиту та пропозиції: ринкова рівновага.
- Взаємозв'язок сукупного попиту та сукупної пропозиції. Макроекономічна рівновага
- Вибір фірмою обсягу виробництва і рівновага конкурентного ринку у довгостроковій перспективі
- Гази крові, та кислотно-лугова рівновага.
- Графік 11. Ринкова рівновага
- Графічна модель грошового ринку. рівновага на грошовому ринку та процент
- Грошова маса і рівновага на ринку грошей
| <== попередня сторінка | | | наступна сторінка ==> |
| Фактори, що зумовлюють рух лімфи в лімфатичних судинах | | | Матеріальний баланс |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |