
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
РЕЧОВИН І МАТЕРІАЛІВ
ПОЖЕЖОВИБУХОНЕБЕЗПЕЧНІ ВЛАСТИВОСТІ
Розділ II. ЗАГАЛЬНІ ВІДОМОСТІ ПРО ГОРІННЯ.
ЛЕКЦІЯ 2. Теоретичні основи процесів горіння та вибуху[1]
Наука про горіння - надзвичайно багатобічна галузь. Прояви горіння досить різноманітні: швидке згоряння горючих парів у двигунах внутрішнього згоряння, регулювання спалювання палива в теплоенергетичних установках, утилізація горючих відходів тощо. Наше завдання - розглянути процес горіння відносно до явищ, пов'язаних з пожежами.
ГОРІННЯ можна визначити як екзотермічну реакцію окиснення речовини, яка супроводжується виділенням диму та (або) виникненням полум'я та (або) світінням.
ГОРІННЯ є з'єднання кисню або іншого окисника з горючою речовиною.
Дамо визначення вищевказаним явищам:
ПОЛУМ'Я - це зона горіння в газовій фазі з видимим випромінюванням світла.
СВІТІННЯ - безполуменеве горіння матеріалу (речовини) в твердій фазі з видимим випромінюванням світла із зони горіння.
ДИМ - видимі тверді та (або) рідкі частинки в газах, що утворюються в результаті горіння або піролізу матеріалів.
З'єднання окисника з горючою речовиною носить екзотермічний характер, тобто має місце виділення теплової енергії. Для деяких горючих речо вин така реакція може початися за нормальними температурами навколишнього середовища під дією безпосередньо кисню повітря або ряду інших стимулюючих чинників. Однак лише у виключних випадках подібні реакції можуть призвести до пожежі, тому що швидкість їх перебігу невисока і у речовин з малою теплопровідністю тепло що розсіюється в навколишнє середовище, викликає незначне підвищення температури речовини.
При певній температурі (температурі займання), що залежить від природи речовини та деяких інших факторів, виникає активізація, різко підвищується рівноважна температура і речовина займається. Для того щоб мало місце спалахування, тобто займання, що супроводжується появою полум'я, речовина повинна розпочати виділяти горючі гази або пари в результаті випаровування, розкладу або хімічної реакції. У протилежному випадку горіння буде безполуменевим.
Горіння виникає за одночасної наявності трьох основних та деяких додаткових умов, наведених на рис. 2.1. Розглянемо їх.
ДЖЕРЕЛО ЗАПАЛЮВАННЯ - це теплова енергія, що призводить до займання. Це джерело повинно мати певний запас енергії та температуру, достатню для початку реакції. Горюча речовина (пальне) та окисник повинні знаходитися в необхідному співвідношенні один з одним. Як правило, окисник - це кисень повітря, вміст якого в атмосфері, що нас оточує, становить близько 21%.
Основні необхідні умови Додаткові умови
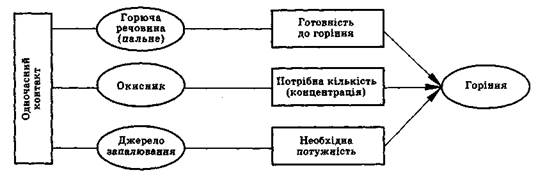
Рис. 2.1. Умови виникнення горіння
Горючі речовини разом з окисником утворюють горючу систему (горючу суміш).
Широко використовується поняття ГОРЮЧЕ СЕРЕДОВИЩЕ. Це середовище, що здатне самостійно горіти після видалення джерела запалювання.
Горючі суміші, залежно від співвідношення пального та окисника, поділяються на:
бідні, що вміщують у достатку, в порівнянні зі стехіометричним співвідношенням компонентів, окисник;
багаті, що вміщують у достатку пальне.
У разі, коли співвідношення між компонентами горючої суміші таке, що згоряння проходить повністю та в продуктах горіння відсутні вихідні речовини, ми маємо справу зі СТЕХІОМЕТРИЧНОЮ горючою системою.
Для повного згоряння необхідна наявність достатньої кількості кисню, щоб забезпечити повне перетворення пального в його насичені оксиди. При недостатній подачі повітря окиснюється тільки частина речовини. Залишок розкладається з виділенням великої кількості диму. При цьому утворюється найбільш розповсюджений продукт неповного згоряння - оксид вуглецю (СО). Дим складається з твердих та рідких частинок, які залишаються у завислому стані в газоподібних продуктах горіння та пересуваються разом з ними. Речовини, в продуктах розкладу яких вміщується більший процент важких фракцій, наприклад смоли, утворюють густий дим.
На пожежах, як правило, горіння відбувається за браком окисника, що призводить до утворення неповних продуктів горіння та виділення диму. У свою чергу, такі обставини серйозно ускладнюють пожежогасіння внаслідок погіршення видимості або наявності токсичних речовин у повітряному середовищі.
Надлишок повітря, з іншого боку, охолоджує газоподібні продукти горіння. У тих випадках, коли пального небагато, охолодження буває достатньо, щоб загасити вогонь, оскільки температура падає нижче рівня, необхідного для займання. Саме таке явище має місце, коли задувають свічку. У той же час сильний вітер під час лісової пожежі здійснює зворотну дію, тому що маса горючого матеріалу та об'єм газоподібних продуктів горіння надто великі, щоб могло бути здійснено необхідне охолодження.
Горіння деяких речовин (наприклад, ацетилену, оксиду етилену тощо), які здатні при розкладанні виділяти велику кількість тепла, можливо й за відсутності окисника.
Горіння являє собою незворотний процес, тому що з продуктів горіння та термічного розкладу неможливо знову створити речовину, що згоріла. Під час простого згоряння речовини має місце руйнування хімічної структури та визволення дози енергії.
Основні СТАДІЇ ПОЛУМЕНЕВОГО ГОРІННЯ представлені на рис. 2.2.
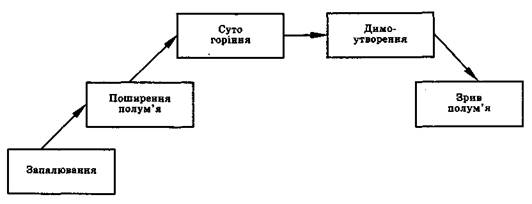
Рисунок 2.2 - Основні стадії полуменевого горіння
У всіх випадках для горіння характерні три типові стадії: виникнення, поширення та згасання полум'я. Найбільш загальними властивостями горіння є здатність осередку полум'я, яке виникло, пересуватися по всій горючій суміші шляхом передачі тепла або дифузії активних частинок із зони горіння в свіжу суміш. Звідси виникає й механізм поширення полум'я, відповідно ТЕПЛОВИЙ та ДИФУЗІЙНИЙ. Горіння проходить, як правило, за комбінованим тепловим дифузійним механізмом.
Існує два режими проходження горіння:
САМОСПАЛАХУВАННЯ - полягає в різкому збільшенні швидкості екзотермічних об'ємних реакцій, що супроводжується полуменевим горінням, тобто - це самочинне виникнення полуменевого горіння попередньо нагрітої до певної критичної температури горючої суміші. Така температура має назву ТЕМПЕРАТУРИ САМОСПАЛАХУВАННЯ.
ПОШИРЕННЯ ФРОНТУ ПОЛУМ'Я (МЕЖІ ЗОНИ ГОРІННЯ В ГАЗОВІЙ ФАЗІ) здійснюється по холодній суміші під час її локального займання (спалахування) від зовнішнього джерела.
Для того, щоб отримати уявлення про поширення фронту полум'я, помістимо гомогенну горючу суміш в скляну трубку, відкриту з одного кінця (рис. 2.3), та запалимо її за допомогою зовнішнього джерела запалювання.

Рисунок 2.3 ‑ Схема поширення полум'я в гомогенній газовій суміші:
1- скляна трубка; 2 - джерело запалювання;
3 - фронт полум'я; 4 - напрямок поширення полум'я
Спочатку полум'я поширюється сферично. При досягненні стінок трубки воно перетворюється в плоский вузький - завтовшки менш 10~6 м фронт, що рухається у бік свіжої суміші. Продукти горіння, що утворюються, об'єм яких внаслідок підвищення температури в декілька разів перевищує об'єм вихідної суміші, витікають з трубки через відкритий кінець. Швидкість переміщення фронту полум'я відносно неспаленого газу по нормалі до його поверхні називається НОРМАЛЬНОЮ ШВИДКІСТЮ ПОШИРЕННЯ ПОЛУМ'Я та позначається Uн.
Нормальна швидкість поширення полум'я характеризується мінімальною величиною, не залежить від умов, а тільки лише від хімічного складу горючої суміші та співвідношення пального з окисником. Максимальне значення 17Н відповідає стехіометричному співвідношенню компонентів горючої суміші. Цей показник має характер фізико-хімічної константи.
У разі закриття вільного кінця трубки, нагріті продукти горіння будуть, як поршень тиснути на полум'я та збільшувати швидкість його переміщення. Сумарна швидкість такого переміщення фронту полум'я називається ВИДИМОЮ ШВИДКІСТЮ ПОЛУМ'Я та позначається С/в. її можна визначити через співвідношення
UB = UH·ε, (2.1)
де ε - ступінь розширення продуктів горіння, що розраховується за формулою
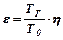 (2.2)
(2.2)
де η - відношення числа молей продуктів горіння до числа молей вихідної суміші;
Тг, То - відповідно температури горіння та початкова.
Величина η для вуглеводневих горючих речовин близька до одиниці. Схема дифузійного горіння наведена на рис. 2.4.
У процесі дифузійного горіння полум'я наче стоїть на місці, а в нього втікають з одного боку - горючі пари та гази (зона А), з іншого боку - повітря (зона В).

Рис. 2.4. Схема дифузійного горіння:
А - зона горючих парів;
Б - зона горіння;
В - навколишнє середовище (повітря)
Важливішою особливістю всіх процесів горіння є самоприскорювальний характер хімічної реакції.
Виходячи з уявлення про кінетику хімічних реакцій, швидкість реакції описується рівнянням Арреніуса:
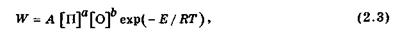
де [П] та [О] - відповідно концентрації пального та окисника;
А - передекспонента;
а та b - стехіометричні коефіцієнти, з якими беруть участь в реакції компоненти горючої суміші;
Е - енергія активації, яка потрібна для такого послаблення внутрішньомолекулярних зв'язків, щоб розпочалася реакція;
Т - температура;
Д - газова стала.
Самоприскорені перетворення при горінні можуть відбуватися за ТЕПЛОВИМ та ЛАНЦЮГОВИМ механізмами.
Суть теплового механізму полягає в зростанні W зі збільшенням Т, а збільшення Т, в свою чергу, зумовлене екзотермічністю реакції окиснення-відновлення. Згідно з теорією «теплового вибуху», розігрів у горючій суміші при її послідовному нагріванні зовні зумовлюється співвідношенням швидкостей процесів тепловиділення 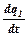 та тепловідведення з зони реакції
та тепловідведення з зони реакції 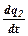 і виникає при досягненні умови:
і виникає при досягненні умови:
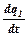 ≥
≥ 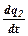 (2.4)
(2.4)
Оскільки 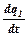 = QW змінюється згідно з рівнянням (2.3) за температурою експоненціальнj (де Q - тепловий ефект реакції; W - швидкість реакції), а
= QW змінюється згідно з рівнянням (2.3) за температурою експоненціальнj (де Q - тепловий ефект реакції; W - швидкість реакції), а
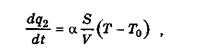 (2.5)
(2.5)
змінюється з температурою лінійно, то зі зростанням температури інтенсивність тепловиділення починає випереджати інтенсивність тепловідведення.
У виразі (2.5):
α - коефіцієнт тепловіддачі в стінки реакційної посудини;
S - поверхня посудини;
V - об'єм посудини;
Т, Т0 - температури поточна та початкова.
Таким чином, при безперервному нагріванні горючої суміші обов'язково повинна досягатися умова, що визначена нерівністю (2.4). Найнижча температура, за якої досягається ця умова, є температурою самозаймання.
Прискорення реакції може досягатися не тільки через підвищення температури при саморозігріванні протягом екзотермічної реакції, але й в результаті особливого характеру хімічних перетворень при горінні - ЛАНЦЮГОВИХ РЕАКЦІЙ. Носіями таких реакцій є особливо активні частинки: радикали та атоми, які мають вільні валентні зв'язки. Коли ці частинки зштовхуються з вихідними молекулами або продуктами перетворювання, взаємодія між ними має місце при значно менших значеннях енергії активації, ніж при молекулярних процесах. В особливого роду ланцюгових реакціях, що називаються РОЗГАЛУЖЕНИМИ, швидкість реакції бурхливо зростає за рахунок того, що внаслідок взаємодії активного центра з молекулою утворюється декілька активних центрів. Від додатково створених активних частинок виникають власні ланцюги перетворень, які призводять до ще більшого накопичення активних центрів та лавиноподібного зростання швидкості сумарного процесу. У той же час в деяких реакціях активні частинки можуть взаємодіяти з іншими частинками таким чином, що активні центри взагалі не будуть утворюватися, що призведе до розірвання ланцюгової реакції. Кінцевий результат залежить від співвідношення швидкостей реакцій розгалуження та розірвання ланцюгів.
Характерним прикладом розгалуженої ланцюгової реакції є окиснення водню, що проходить за такою схемою:
H2 + О2 → 2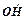 - зародження ланцюга,
- зародження ланцюга,
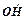 + H2 → Н2О +
+ H2 → Н2О +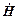 - подовження ланцюга,
- подовження ланцюга,
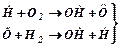 - розгалуження ланцюга,
- розгалуження ланцюга,
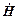 +
+ 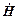 + стінка - обривання ланцюга на стінці посудини,
+ стінка - обривання ланцюга на стінці посудини,
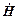 + О2+ М →
+ О2+ М →  + М - розривання ланцюга при потрійному зіткненні за участю інертної молекули М (обривання в об'ємі суміші).
+ М - розривання ланцюга при потрійному зіткненні за участю інертної молекули М (обривання в об'ємі суміші).
З наведеної схеми видно, що протягом одного циклу перетворень кожний атом водню, що вступає в реакцію, призводить до утворення трьох нових активних частинок, позначених точками над відповідними хімічними символами. Якщо розгалуження проходить частіше, ніж обривання ланцюга, то швидкість реакції буде безперервно зростати, що призведе кінець кінцем до самозаймання. При цьому в даному випадку для прискорення реакції не потрібно нагрівати суміш. Екзотермічний хімічний процес, що розпочався ланцюговим шляхом, супроводжується виділенням тепла, яке призводить до теплового самоприскорення.
Слід відзначити, що в умовах реальної пожежі горіння проходить за комбінованим ланцюгово-тепловим механізмом.
Надзвичайно швидке хімічне перетворення речовини, що супроводжується виділенням енергії та утворюванням стиснених газів, здатних виконувати механічну роботу, називається ВИБУХОМ.
Під час вибуху відбувається процес вивільнення великої кількості енергії в обмеженому об'ємі за короткий проміжок часу.
Вибухонебезпечна (або вибухова) суміш, яка заповнює об'єм, в якому була виділена енергія, перетворюється в сильно нагрітий газ з високим тиском. Цей газ з великою силою діє на навколишнє середовище, здійснює утворювання вибухової хвилі. З віддаленням від місця вибуху механічна дія вибухової хвилі послаблюється.
Реальні вибухи газопилоповітряних сумішей мають здебільшого дефлаграційний характер. Як приклад розглянемо процес розвитку вибуху стехіометричної вуглеводнеповітряної суміші в обмеженому просторі. Стехіометричний склад суміші зумовлює розвиток рівномірно поширюваного на всі боки сферичного полум'я. Припустимо, що після займання в центрі хмари цієї суміші полум'я поширюється з постійною швидкістю відповідно до формули (2.1). При цьому буде розвиватися надлишковий тиск, швидкість збільшення якого буде визначатися швидкістю накопичення продуктів горіння, тобто швидкістю розширення сфери, обмежованої фронтом полум'я:
 (2.6)
(2.6)
де q - об'єм продуктів горіння, м3;
V - об'єм об'єкта, м8.
Разом з накопиченням продуктів горіння проходить витікання газів з об'єкта через нещільності та отвори. Витрата газу при цьому визначається за формулою
 (2.7)
(2.7)
де μ - коефіцієнт витрати;
f - сумарна площа нещільностей, м2;
W - швидкість витікання газів, м-с-1;
ρ - густина газів, що витікають, кг-м-3.
Підсумований тиск вибуху в кожний момент часу можна визначити спільним розв'язанням обох рівнянь.
Читайте також:
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- IV. Запасні речовини
- L2.T4. Транспортування рідких, твердих та газоподібних речовин.
- L2.T4/1.1. Засоби періодичного транспортування штучних матеріалів.
- L2.T4/1.2. Засоби безперервного транспортування матеріалів. Транспортери.
- L2.T4/1.3. Засоби дозування сипучих матеріалів.
- L2.T4/1.Переміщення твердих речовин по території хімічного підприємства.
- Аварії з викидом (загрозою викиду) сильнодіючих отруйних речовин на об'єктах економіки.
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аваріїз витоком сильнодіючих отруйних речовин.
- Агрегатні стани речовини
Переглядів: 1172
| <== попередня сторінка | | | наступна сторінка ==> |
| ДЕРЖАВА - ГОЛОВНИЙ ІНСТИТУТ ПОЛІТИЧНОЇ СИСТЕМИ | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |