
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Енергія молекул. Молекулярні спектри
Молекула, як система ядер і електронів, може здійснювати наступні рухи: поступальний, обертальний, коливальний, електронний, ядерний. Якщо в першому наближенні ці рухи вважати незалежними, то енергія молекул запишеться як
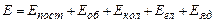 . (7.63)
. (7.63)
 Оскільки енергія поступального руху не квантується, то вона нас цікавити не буде. Ядерна енергія квантується, але відстані між ядерними енергетичними рівнями настільки великі (див. розділ 8), що у звичайних умовах енергія ядерного руху залишається незмінною. І тому в подальшому Епост та Еяд у виразі (7.63) опускатимемо.
Оскільки енергія поступального руху не квантується, то вона нас цікавити не буде. Ядерна енергія квантується, але відстані між ядерними енергетичними рівнями настільки великі (див. розділ 8), що у звичайних умовах енергія ядерного руху залишається незмінною. І тому в подальшому Епост та Еяд у виразі (7.63) опускатимемо.
 7.10.1. При утворенні молекул з окремих атомів зв’язок між ними забезпечується не всіма електронами, але лише валентними. І тому зміна електронної енергії молекул зумовлена зміною стану валентних електронів. Обмежимось розглядом двохатомних молекул (наприклад, NaCl і H2). У випадку молекули NaCl атом Na легко іонізується і валентний електрон переходить до атома Cl. Таким чином, маємо справу з двома протилежно зарядженими іонами: Na+ і
7.10.1. При утворенні молекул з окремих атомів зв’язок між ними забезпечується не всіма електронами, але лише валентними. І тому зміна електронної енергії молекул зумовлена зміною стану валентних електронів. Обмежимось розглядом двохатомних молекул (наприклад, NaCl і H2). У випадку молекули NaCl атом Na легко іонізується і валентний електрон переходить до атома Cl. Таким чином, маємо справу з двома протилежно зарядженими іонами: Na+ і 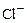 . Зв’язок в молекулах такого типу називають іонним або гетерополярним. Зрозуміло, що одночасно з силами кулонівського притягання існують і сили відштовхування між атомами (особливо сильні на малих відстанях). І тому потенціальна енергія взаємодії атомів в залежності від відстані має вигляд потенціальної ями.
. Зв’язок в молекулах такого типу називають іонним або гетерополярним. Зрозуміло, що одночасно з силами кулонівського притягання існують і сили відштовхування між атомами (особливо сильні на малих відстанях). І тому потенціальна енергія взаємодії атомів в залежності від відстані має вигляд потенціальної ями.
У випадку молекули H2 обидва валентних електрони належать одночасно обом атомам (ядрам). Розв’язок рівняння Шредінгера для такої системи (Гайтлер і Лондон, 1927р.) дає для електронної енергії молекули вирази
 (7.64)
(7.64)
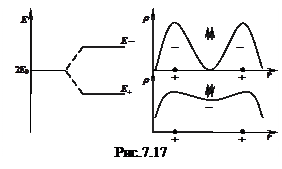
 де Е0 – енергія електрона в ізольованому атомі, К – кулонівський інтеграл, який враховує попарну кулонівську взаємодію усіх частинок системи, S – інтеграл перекриття, який враховує перекриття хвильових функцій обох електронів, А – обмінний інтеграл, який враховує нерозрізняльність електронів, що ніби "належать" то одному, то іншому атому. Таким чином, електронний рівень ізольованого атому в молекулі зазнає розщеплення (рис. 7.17, а). При цьому кожному з розв’язків (7.64) відповідає свій просторовий розподіл густини електронного заряду (рис. 7.17, б).
де Е0 – енергія електрона в ізольованому атомі, К – кулонівський інтеграл, який враховує попарну кулонівську взаємодію усіх частинок системи, S – інтеграл перекриття, який враховує перекриття хвильових функцій обох електронів, А – обмінний інтеграл, який враховує нерозрізняльність електронів, що ніби "належать" то одному, то іншому атому. Таким чином, електронний рівень ізольованого атому в молекулі зазнає розщеплення (рис. 7.17, а). При цьому кожному з розв’язків (7.64) відповідає свій просторовий розподіл густини електронного заряду (рис. 7.17, б).
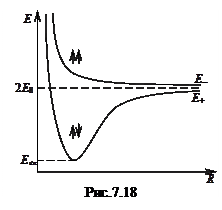
Оскільки за рахунок коливального руху атомів відстань між ними (R) змінюється, то слід очікувати залежність електронної енергії від R (рис. 7.18). Важливо відмітити, що стан з енергією Е– реалізується при паралельній (↑↑) орієнтації спінів електронів, а стан з енергією Е+ - при антипаралельній (↑↓) орієнтації спінів. Зрозуміло, що тільки залежність Е(R) з мінімумом відповідає стійкому стану молекули. Зв’язок в молекулах, який забезпечується антипаралельними (спареними) спінами електронів, називають ковалентним або гомеополярним.
7.10.2. Розглядаючи двохатомну молекулу як квантовий лінійний гармонічний осцилятор (§7.5), енергію коливального руху молекули запишемо як
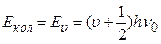 , (7.65)
, (7.65)
де 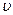 = 0,1,2, … – коливальне квантове число.
= 0,1,2, … – коливальне квантове число.
Кожний електронний рівень (електронна конфігурація) має свою сукупність коливальних рівнів (рис. 7.19). Формула (7.65) справедлива лише при малих значеннях 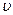 , коли крива Е(R) близька до параболи. При великих інтенсивностях коливального руху (великих
, коли крива Е(R) близька до параболи. При великих інтенсивностях коливального руху (великих 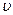 ) потрібно врахувати відхилення від гармонічності (ангармонізм), і енергія коливального руху молекули запишеться як
) потрібно врахувати відхилення від гармонічності (ангармонізм), і енергія коливального руху молекули запишеться як
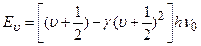 ,
,
де γ – коефіцієнт ангармонічності. Зрозуміло, що в цьому випадку коливальні енергетичні рівні вже не є еквідистантними, а згущуються.
7.10.3. Енергія обертального руху двохатомної молекули
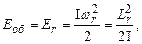 (7.66)
(7.66)
де I – момент інерції молекули відносно осі обертання, що перпендикулярна до лінії, яка сполучає атоми, і проходить через центр молекули; 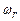 - кутова швидкість обертання молекули;
- кутова швидкість обертання молекули; 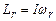 – момент імпульсу молекули. Останній квантується так, як і орбітальний момент імпульсу електрона в атомі (7.48), тобто
– момент імпульсу молекули. Останній квантується так, як і орбітальний момент імпульсу електрона в атомі (7.48), тобто
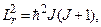 (7.67)
(7.67)
де J = 0,1,2,3, … – обертальне квантове число.
Підставивши (7.67) у (7.66), отримаємо
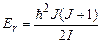 . (7.68)
. (7.68)
Момент інерції молекули розраховується як
 ,
,
де 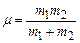 – зведена маса молекули, атоми якої мають маси m1 та m2 ; d – відстань між центрами атомів.
– зведена маса молекули, атоми якої мають маси m1 та m2 ; d – відстань між центрами атомів.
7.10.4.Підставляючи у (7.63) вирази (7.65) і (7.68), отримаємо повну енергію молекули (в гармонічному наближенні):
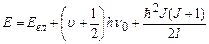 . (7.69)
. (7.69)
 При цьому між енергіями різних форм руху молекули мають місце наступні нерівності:
При цьому між енергіями різних форм руху молекули мають місце наступні нерівності:  . Енергетична діаграма, які відповідає виразу (7.69), для двох електронних конфігурацій представлена на рис. 7.20. Видно, що для відстаней між енергетичними рівнями різних форм руху також мають місце нерівності:
. Енергетична діаграма, які відповідає виразу (7.69), для двох електронних конфігурацій представлена на рис. 7.20. Видно, що для відстаней між енергетичними рівнями різних форм руху також мають місце нерівності:  Якщо певним (тепловим, оптичним тощо) чином перевести молекулу в збуджений стан, то при переході на нижчі рівні будуть випромінюватись кванти світла різної енергії. Але, як правило, досліджуються не спектри випромінювання, а спектри поглинання. Зумовлено це тим, що при помірних температурах молекули перебувають переважно у найнижчих електронних і коливальних станах. І тому спектри випромінювання мають мало ліній слабкої інтенсивності. Зрозуміло, що такі обмеження не поширюються на спектри поглинання, які формуються при переході з нижчих на вищі рівні під дією світла.
Якщо певним (тепловим, оптичним тощо) чином перевести молекулу в збуджений стан, то при переході на нижчі рівні будуть випромінюватись кванти світла різної енергії. Але, як правило, досліджуються не спектри випромінювання, а спектри поглинання. Зумовлено це тим, що при помірних температурах молекули перебувають переважно у найнижчих електронних і коливальних станах. І тому спектри випромінювання мають мало ліній слабкої інтенсивності. Зрозуміло, що такі обмеження не поширюються на спектри поглинання, які формуються при переході з нижчих на вищі рівні під дією світла.
Розрізняють наступні типи спектрів поглинання молекул: обертальні (І), коливально-обертальні (ІІ) і електронно-коливально-обертальні (ІІІ) (рис. 7.20). Обертальні спектри виникають при переходах між обертальними рівнями молекули однієї електронно-коливальної конфігурації; при цьому виконуються правила відбору 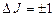 . Енергія поглинутих фотонів
. Енергія поглинутих фотонів
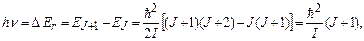 (7.70)
(7.70)
а їх частота  .
.
Остання формула дозволяє за експериментальними значеннями частот (довжин хвиль) обертального спектру визначати момент інерції молекул. Відмітимо, що обертальні спектри лежать у далекій інфрачервоній області (l = 10-4¸10-3 м), на межі з ультрарадіодіапазоном.
Коливально-обертальні спектри формуються при переходах між обертальними рівнями молекули в різних коливальних конфігураціях, але однієї електронної конфігурації; при цьому виконуються наступні правила відбору: Du = ±1, DJ = ±1. Енергія поглинутих фотонів (для малих u, коли справедлива формула(7.65))
 (7.71)
(7.71)
а частота 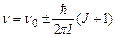 .
.
Такий спектр являє собою смугу близьких ліній, розміщених симетрично відносно уявної v0‑лінії, яка не реалізується. Зрозуміло, що остання формула дозволяє встановити як момент інерції молекули, так і частоту її власних коливань. Коливально-обертальні смуги лежать в середній ІЧ-області (l » 10-5 м).
Електронно-коливально-обертальні спектри поглинання формуються при переходах між обертальними рівнями молекули в різних електронних конфігураціях; при цьому виконуються правила відбору: Du = ±1, DJ = 0, ±1. Отже, кожній парі електронних рівнів відповідає група смуг коливально-обертального спектру. Ці смуги лежать як у близькій ІЧ-області, так і у видимій області (l £ 10-6 м).
Читайте також:
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- Аналогія величин і рівнянь поступального і обертального руху. Кінетична енергія обертання тіла
- Білки – це високомолекулярні органічні біополімери, мономерами яких є амінокислоти.
- В однакових об'ємах різних газів за однакових умов (температура і тиск) міститься однакова кількість молекул.
- Важливим параметром конденсаторів є пробивна напруга конденсатора. Чим вона більша, тим надійніший конденсатор, тим більша енергія може сконцентруватись на ньому.
- Високомолекулярні сполуки ВМС
- Власна енергія зарядів.
- Властивості молекул.
- Внутрішня енергія реального газу
- Внутрішня енергія реального газу
- Внутрішня енергія системи
- Внутрішня енергія та ентальпія
| <== попередня сторінка | | | наступна сторінка ==> |
| Характеристичне рентгенівське випромінювання | | | Люмінесценція |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |