
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Термодинамічні потенціали
Багато процесів хімічної технології проходять при постійних тиску і температурі, якщо вони відбуваються у відкритих апаратах, або при постійних об¢ємі і температурі, якщо вони відбуваються у закритих апаратах, наприклад, у автоклавах. У фізичній хімії про напрямок процесу та рівновагу у системі при постійних тиску і температурі роблять висновок за енергією Гіббса або при постійних об¢ємові і температурі – за енергією Гельмгольца. Це пов¢язане з тим, що на практиці розгляд ізольованих систем і використання DS як критерію рівноваги та напрямку процесу є дуже незручним, оскільки розглядання ізольованої системи часто стикається з великими труднощами. Але за допомогою ентропії можна обчислити інші функції - енергію Гіббса та енергію Гельмгольца, які є критеріями рівноваги і напрямку процесу при постійних темпері і тиску або при постійних температурі і об¢ємові відповідно.
Запишемо математичні вирази для першого та другого законів термодинаміки: dU = dQ – dA i dQ = TdS.
Отже
dU = TdS - dA (4.1)
Робота процесу в загальному випадку складається з корисної роботи d¢А та роботи сил розширення: dА = dА¢ + +PdV. Корисна робота має найбільше значення у зворотному процесі: dАМ = dА¢М + PdV, де А¢М – максимальна корисна робота; АМ – загальна (максимальна) робота процесу. Для зворотного процесу поєднане рівняння першого та другого законів термодинаміки може бути записане так:
dU = TdS - dA¢M – PdV
або
dA¢M = TdS – dU – PdV (4.2)
При S, V = const рівняння (4.2) набуває вигляду
-dU = dA¢M
або
-DUS,V =A¢M (4.3)
тобто зменшення внутрішньої енергії у зворотному процесі при S, V = const дорівнює максимальній корисній роботі.
При S, P = const з рівняння (4.2) отримуємо:
dA¢M = - (dU+ +PdV) або dA¢M = - d( U + PV ). Знаючи, що
U + PV = H, після інтегрування маємо
-DHS,P = A¢M (4.4)
тобто зменшення ентальпії у зворотному процесі при S,P=const дорівнює максимальній корисній роботі.
Визначимо роботу при постійних V i T. Рівняння (4.2) набуде вигляду: dA¢M = TdS – dU або dA¢M = -d(U – TS). Величина, що міститься під знаком диференціала є функцією стану системи, оскільки і внутрішня енергія, і ентропія – функції стану системи. Вона позначається літерою F і називається енергією Гельмгольца:
F = U – TS (4.5)
З урахуванням цього після інтегрування отримуємо
-DFV,T = A¢M (4.6)
тобто зменшення енергії Гельмгольца у зворотному ізохорно-ізотермічному процесі дорівнює максимальній корисній роботі.
При постійних температурі та тиску у праву частину рівняння (4.2) можна додати VdP i SdT, що дорівнюють нулю. Отримуємо
dA¢M = TdS + SdT – dU – PdV – VdP = -d(U – TS + PV) (4.7)
Вираз у дужках є функцією стану. Він позначається буквою G і називається енергією Гіббса:
G = U + PV – TS = H – TS = F + PV(4.8)
Тому можна записати
-dGP,T = dA¢M .
Після інтегрування отримуємо
-DGP,T = A¢M (4.9)
Отже, зменшення енергії Гіббса у зворотному ізобарно-ізотермічному процесі дорівнює максимальній корисній роботі.
Функція, спадання якої у зворотному процесі, що проходить при постійних значеннях відповідних параметрів, дорівнює максимальній корисній роботі, називається термодинамічним потенціалом.
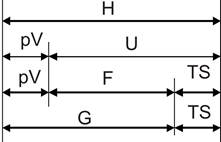
Таким чином, чотири функції стану U, H, F i G поєднані загальною назвою – термодинамічні потенціали. Співвідношення між ними можна зобразити графічно (рис.4.1).
Читайте також:
- БІОЕЛЕКТРИЧНІ ПОТЕНЦІАЛИ
- Електродні потенціали
- Електродні потенціали
- Природні потенціали в свердловині
- Природні потенціали геосистеми та їх оцінка
- Термодинамічні основи роботи компресора
- Термодинамічні потенціали
- Термодинамічні процеси
- Термодинамічні умови фазової рівноваги. Правило фаз
| <== попередня сторінка | | | наступна сторінка ==> |
| Правобережні та західноукраїнські землі у ХVІІІ ст. | | | У системі можуть довільно проходити тільки процеси, що супроводжуються зменшенням термодинамічних потенціалів (за умови сталості відповідних природних змінних). |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |