
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Термодинамічні умови фазової рівноваги. Правило фаз
Згадаємо деякі, вже відомі нам, визначення. Система, що складається із декількох фаз, називається гетерогенною. Фазоюв термодинаміці називається гомогенна частина гетерогенної системи, що має однаковий склад, фізичні та хімічні властивості, відділена від інших частин системи поверхнею поділу, при переході через яку відбувається стрибкоподібне змінення системи.
Компонентом системиназивають будь-яку речовину, що входить до складу системи, яку з останньої можна видалити і яка може існувати у вільному вигляді. Спеціально виділяють поняття незалежного компонента.Справа у тому, що в системі можуть проходити хімічні реакції, і речовини системи не будуть незалежними. Кількість незалежних компонентів дорівнює кількості компонентів мінус кількість хімічних реакцій, що їх зв¢язують. Наприклад, чиста вода за нормальних умов – однокомпонентна система. При температурах порядку 10000С відбувається дисоціація води за рівнянням:
2Н2О = 2Н2 + О2.
Тут уже три речовини, але між ними проходить одна хімічна реакція. Отже, система двокомпонентна.
При описуванні багатокомпонентних систем завжди треба знати їх склад. Існує багато способів вираження складу систем. Найбільш зручним для описування складу багатокомпонентних систем є вираження кількості компонентів у мольних частках. Мольною часткоюкомпонента системи називають відношення кількості молів цього компонента до загальної кількості молів системи. Нехай, наприклад, система складається з трьох компонентів, кількість молів яких відповідно дорівнює n1, n2 i n3. Тоді для мольних часток хі можна записати:
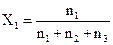 ,
,  ,
, 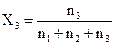 .
.
Мольні частки компонентів зв¢язані між собою рівнянням
Х1 + Х2 + Х3 = 1.
Для багатокомпонентної системи
å Хі = 1. (6.16) Розглянемо тепер рівновагу між фазами, тобто гетерогенну рівновагу. Нехай у системі співіснують Ф фаз, кожна з яких складається із К компонентів. Система перебуває у фазової рівновазі, коли всі фази будуть у термодинамічній, механічній та хімічній рівновазі. Термічна рівновага виражається однаковістю температури у всіх фазах, механічна – тисків, хімічна – однаковістю хімічних потенціалів.
Т1 = Т2 = Т3 = … = Тф,
Р1 = Р2 = Р3 = … = Рф,
m11 = m21 = m31 = … = mф1, (6.17)
m12 = m22 = m32 = … = mф2,
…………………………..,
m1к = m2к = m3к = … = mфк.
Тут верхнім індексом позначається номер компонента, а нижнім – номер фази. Співвідношення (6.17) є термодинамічними умовами фазової рівноваги.
Розрахуємо тепер кількість незалежних змінних, що входять до складу рівняння (6.17) та кількість рівнянь, що зв¢язують ці змінні. У перших двох рядках – 2Ф змінних. Хімічний потенціал залежить від концентрації всіх К компонентів. Однак незалежними будуть тільки (К - 1) компонентів, оскільки частки усіх компонентів у кожній фазі зв¢язані рівнянням åХі = 1. Таким чином, хімічні потенціали К компонентів у Ф фазах можна виразити за допомогою Ф(К – 1) змінних. Загальна кількість змінних у рівностях (6.17) дорівнює 2 Ф + Ф×(К-1).
Кожен рядок рівності (6.17) дає (Ф – 1) рівнянь. Кількість усіх рядків дорівнює (К + 2). Отже, кількість незалежних рівнянь дорівнює (Ф – 1) × (К - 2). Кількість рівнянь не може перевищувати кількості перемінних, оскільки у противному разі рівняння будуть наслідками одне одного або несумісними. Тому можна записати
1Ф + Ф×(К – 1) ³ (Ф – 1)×(К + 2),
звідки
Ф £ К + 2. (6.18)
Це одна з форм запису правила фаз:
Читайте також:
- Аверсивную терапію використовують, як правило, при лікуванні алкоголізму, нікотиновій залежності і деяких інших захворювань.
- Аналогія як умовивід
- Блок 4. Умови та охорона праці.
- Блок перевірки умови
- БУДОВА ТА УМОВИ ФОРМУВАННЯ ШАРУВАТИХ ТОВЩ
- Будучи, як правило, дочірніми фірмами великих компаній, вони існують за рахунок засобів венчурного капіталу і здійснюють чітко визначений вид діяльності.
- В цілому сукупність суспільного продукту – це сукупність благ і послуг, вироблених суспільством за певний період часу (як правило, за рік).
- Види аудиторських висновків та умови їх надання
- Види і типи організаційних структур та умови їх ефективного застосування
- Види й типи організаційних структур та умови їх ефективного застосування
- Винесення внутрішніх, розумових дій назовні називають екстеріоризацією.
- Вирішення суперечок між суб'єктами страхування. Умови припинення дії договору.
| <== попередня сторінка | | | наступна сторінка ==> |
| Рівняння Клапейрона-Клаузіуса | | | СТИСЛИЙ конспект лекцІй |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |