
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Рівняння Клапейрона-Клаузіуса
Рівняння Клапейрона-Клаузіуса відображає особливості фазових переходів першого роду. Виведемо це рівняння, розглядаючи систему, у якій при постійних тиску та температурі у рівновазі перебувають рідина та її пара. Якщо випарити рівноважним чином визначену кількість (наприклад, 1 моль) рідини, то змінення внутрішньої енергії буде дорівнювати
DU = TDS - PDV або
Uп - Uр = T(Sп -Sр ) – P(Vп - Vр ).
Звідси
Uп + PVп - TSп = Uр + PVр - TSр
і
Gп = Gр. (6.2)
Якщо змінити температуру та тиск системи, то мольні енергії Гіббса теж зміняться і будуть дорівнювати
Gп + dGп i Gр + dGр .
Змінення Р і Т проведемо так, щоб система у новому стані знов перебувала у рівновазі. Тоді
Gп + dGп = Gр + dGр ,
dGп = dGр . (6.3)
Тобто, щоб при зміненні температури та тиску рівновага не змінилася, змінювання мольної енергії Гіббса (хімічного потенціалу) пари повинно дорівнювати її зміненню для рідини.
Використовуючи вираз для диференціала енергії Гіббса, отримуємо
-SпdT + VпdP = -SрdT + VрdP,
або
(Vп – Vр)dP = (Sп – Sр)dT. (6.4)
Ураховуючи, що випарювання проводиться при постійній температурі, приріст ентропії при переході рідини у пару можна виразити через приховану теплоту випарювання (DHв)
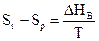 . (6.5)
. (6.5)
Беручи до уваги отримане співвідношення, отримуємо
DНв = T(Vп –Vр) . (6.6)
. (6.6)
Це рівняння Крапейрона-Клаузіуса у диференціальному вигляді. Його можна записати і для інших фазових переходів. Так, для возгонки (сублімації)
DНС = T(Vп –Vт )  . (6.7)
. (6.7)
Для плавлення
DНпл = T(Vр –Vт )  . (6.8)
. (6.8)
У загальному випадку будь-якого фазового переходу
DНф = T(V2 –V1 )  . (6.9)
. (6.9)
Рівняння Клапейрона-Клаузіуса подає залежність тиску пари над рідиною або твердим тілом (рівновага рідина-пара або тверде тіло –пара) від температури або залежність температури плавлення (рівновага тверде тіло – рідина) від тиску. Ці залежності, як правило, подають у вигляді діаграм стану. У наступних розділах при розгляданні діаграм стану ми будемо використовувати виведені співвідношення.
Для фазових переходів з участю пари (випарювання, сублімація, конденсація) отримане рівняння Клапейрона-Клаузіуса можна перетворити у більш зручне для практичного використання рівняння. Для цього необхідно зробити такі припущення:
1 Пар мати за ідеальний газ, для одного моля якого
PV = RT;
2 Знехтувати мольним об¢ємом рідкої або твердої речовини порівняно до мольного об¢єму пари;
3 Знехтувати залежністю теплоти фазового переходу від температури (це справедливо для невеликих інтервалів температур).
Тоді для процесу випарювання, наприклад, можна
записати
DНв = T×Vп  . (6.10)
. (6.10)
Але Vп = RT/P і звідси
 ,
,
aбо
 . (6.11)
. (6.11)
Інтегруючи цей вираз у межах від Р1 до Р2 і відповідно від Т1 до Т2 , отримуємо
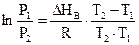 . (6.12)
. (6.12)
При інтегруванні співвідношення (6.11) у вузькому довільному інтервалі температур отримуємо
 . (6.13)
. (6.13)
Тут В – стала інтегрування. Для процесу сублімації
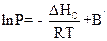 (6.14)
(6.14)
Рівняння (6.13) і (6.14) показують, що логарифм тиску пари над твердою і рідкою речовиною лінійно залежить від зворотної температури (рис.6.1). Нахил цих прямих залежить від величини теплоти фазового переходу. Оскільки DНС > DНв, пряма для твердої речовини є більш крутою, ніж пряма для рідини. Точка перетину цих прямих відповідає температурі плавлення речовини.
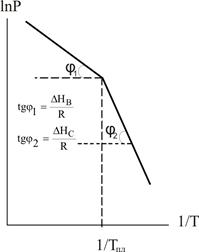
Рисунок 6.1 – Залежність lnP = f(1/T)
Виведені нами залежності lnP = f(1/T) мають велике практичне значення. За допомогою таких рівнянь розраховують значення тиску насиченої пари над рідкою та твердою речовинами при різних температурах. Справа у тому, що у довідниках з фізичної хімії є багато даних що до тисків насичених парів у вигляді коефіцієнтів рівняння:
ln P = B – A/T. (6.15)
Тут А = DН/R, а Р – тиск насиченої пари, що поданий у мм ртутного стовпа. При цьому зазначається температурний інтервал, у якому виконується ця залежність. І якщо необхідно знати тиск насиченої пари над будь-якою речовиною, зовсім необов¢язково виміряти цей тиск експериментально, а слід лише знайти коефіцієнти А і В у довіднику. Наприклад, тиск насиченої пари над твердим ZnCl4 відшукують за допомогою рівняння
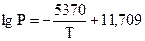 (503-673 K).
(503-673 K).
Звідки DНС (ZnCl4) = 102,7 кДж/моль.
Читайте також:
- V Процес інтеріоризації забезпечують механізми ідентифікації, відчуження та порівняння.
- Асимптотичний підхід до порівняння оцінок
- Бюджетний контроль - це порівняння показників бюджету зі звітом за відповідний період часу.
- В обох випадках основним розрахунковим рівнянням є рівняння теплопередачі і теплового балансу
- Вивід основного рівняння фільтрації
- Гармонічні коливання. Диференціальне рівняння гармонічних коливань та його розв’язок. Амплітуда, фаза, частота, період коливань
- Головне рівняння відцентрового насоса. Теоретичний напір.
- Два означення інтегралу. Теореми про загальний вигляд інтегралу та залежність двох інтегралів одного диференціального рівняння.
- Десяткові дроби, їх порівняння, операції над ними. Перетворення десяткових дробів у звичайні та звичайних у десяткові.
- Динамічна інтерпретація диференційного рівняння другого порядку. Консервативні системи.
- Диференціальне рівняння
- Диференціальне рівняння Ейлера для потоку рідини.
| <== попередня сторінка | | | наступна сторінка ==> |
| Методологія SCM: ключ до погодженого бізнесу | | | Термодинамічні умови фазової рівноваги. Правило фаз |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |