
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Поняття про енергію активації хімічної реакції
Кінетична класифікація гомогенних хімічних реакцій
Oсновні поняття та визначення хімічної кінетики
Питання
ЛЕКЦІЯ № 9 формальна кінетика
9.1 Поняття про енергію активації хімічної реакції
9.4 Способи визначення порядку реакції
На попередніх лекціях ми вивчили основні закономірності хімічних процесів з точки зору хімічної термодинаміки. Такий підхід дозволяє нам на основі вивчення енергетичних властивостей системи та її ентропії визначити рівноважний стан, тобто можливий кінцевий результат хімічної взаємодії. При цьому дуже часто отриманий із термодинамічного розгляду висновок про перебіг процесу не означає, що дана хімічна реакція у дійсності проходить в умовах, що розглядаються. Наприклад, нас цікавить перетворення однієї кристалічної модифікації вуглеводню – алмазу – в іншу його модифікацію – графіт:
С (алмаз)  С (графіт).
С (графіт).
Термодинамічне вивчення такої системи показує, що при стандартних умовах графіт більш стійкий, ніж алмаз: Gгр = -1,71 кДж/моль, Gал = 1,18 кДж/моль. Тому у зазначених умовах алмаз повинен самодовільно перетворюватися у графіт, оскільки D G = Gгр – Gал = = -2,89 кДж/моль. У дійсності цього перетворення не відбувається. Така уявна суперечність теоретичних розрахунків і практичних спостережень пояснюється обмеженістю термодинамічного методу, оскільки він розглядає лише початковий та кінцевий стан системи.
Дійсно, за звичайних умов вільна енергія графіту менша за вільну енергію алмазу. Справа в тому, що перетворення кристалічної ґратки алмазу в ґратку графіту обов¢язково відбувається через якісь проміжні структури, що відрізняються від обох ґраток (рис.9.1).
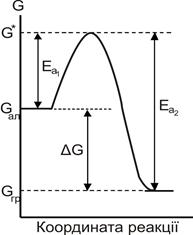
Рисунок 9.1 – До визначення енергії активації
Утворення проміжних структур пов¢язане з витратами енергії, що досягає G* . Тому фактичне змінювання енергії у процесі реакції зобразиться кривою з максимумом. Висоту максимуму у порівнянні з енергією вихідної речовини називають енергією активації даної хімічної реакції Еа.Іншими словами, термодинамічно можливий перехід системи з початкового стану в кінцевий пов¢язаний з подоланням енергетичного бар’єра, що уповільнює реальний перебіг процесу, особливо за низьких температур.
Можна навести багато прикладів, коли термодинамічно можливі процеси практично не здійснюються через дуже малі швидкості. Так, реакція взаємодії водню та кисню
2 Н2 + О2  2Н2О
2Н2О
супроводжується дуже великою втратою вільної енергії DG298= - 455,6 кДж/моль, тобто процес повинен проходити самодовільно. Однак відомо, що суміш цих газів ( гримуча суміш) може перебувати багато часу без помітного утворення води. Справа знову у високому енергетичному бар’єрі, у високій енергії активації.
Зробимо визначення цієї величини. Енергія активації – це та надлишкова кількість енергії ( у порівнянні з середньою величиною), яку повинні мати молекули у момент зіткнення, щоб прореагувати. Ця надлишкова енергія може бути у молекулах у різних формах. Це може бути: 1) підвищена кінетична енергія поступового або обертального руху молекули; 2) підвищена енергія внутрішньо молекулярних коливань атомів; 3) підвищена енергія руху електронів тощо.
Як бачимо з рис. 9.1, енергії активації прямої (Еа1) і зворотної (Еа2) реакцій різні. Наприклад, для реакції
Н2 + І2 = 2НІ
Еа1 = 166,0 кДж/моль, а Еа2 = 185,6 кДж/моль.
З вищезазначеного зрозуміло, що вивчення хімічних систем з однієї лише термодинамічної точки зору недостатньо. Не менш важливе вивчення у іншому аспекті – з точки зору швидкостей процесів та їх механізмів, тобто з точки зору кінетики.
Читайте також:
- II. Поняття соціального процесу.
- V. Поняття та ознаки (характеристики) злочинності
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- А/. Поняття про судовий процес.
- Аварійне та довгострокове прогнозування хімічної обстановки
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Адміністративний проступок: поняття, ознаки, види.
- Адміністративні провадження: поняття, класифікація, стадії
- Акти застосування юридичних норм: поняття, ознаки, види.
- Аналіз ступеня вільності механізму. Наведемо визначення механізму, враховуючи нові поняття.
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Кінетики |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |