
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
СТИСЛИЙ конспект лекцІй
Дуже часто отриманий із термодинамічного розгляду висновок про перебіг процесу не означає, що дана хімічна реакція у дійсності проходить в умовах, що розглядаються.
Можна навести багато прикладів, коли термодинамічно можливі процеси практично не здійснюються через дуже малі швидкості. Так, реакція взаємодії водню та кисню
2 Н2 + О2  2Н2О
2Н2О
супроводжується дуже великою втратою вільної енергії DG298= - 455,6 кДж/моль, тобто процес повинен проходити самодовільно. Однак відомо, що суміш цих газів ( гримуча суміш) може перебувати багато часу без помітного утворення води. Справа у високому енергетичному бар’єрі, у високій енергії активації.
Зробимо визначення цієї величини. Енергія активації – це та надлишкова кількість енергії ( у порівнянні з середньою величиною), яку повинні мати молекули у момент зіткнення, щоб прореагувати.
Швидкістю хімічної реакції W- називають змінювання кількості будь-якої речовини (або вихідної, або продукту) ni за одиницю часу t та за одиниці реакційного простору R:
W = ± 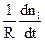
Наведене визначення швидкості хімічної реакції є загальним, воно справедливе для будь-яких реакцій. Якщо реакція гомогенна та проходить у об’ємі, то реакційним простором є об’єм (R º V). Якщо реакція гетерогенна і проходить на поверхні розподілу фаз, то реакційним простором є ця поверхня
(R º S).
Найбільш теоретично описаними з точки зору хімічної кінетики є гомогенні реакції в ізольованих або закритих системах. У цьому випадку для швидкості реакції можна записати
W = ±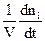 .
.
Якщо V = const, то враховуючи, що ni/V = Ci, де Сі – концентрація будь-якого компонента, можна записати
W = ± 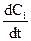 .
.
Математичне рівняння, що пов’язує швидкість реакції з концентраціями речовин, що реагують, називають кінетичним рівняннямданої хімічної реакції. Слід зазначити, що за зовнішнім виглядом рівняння хімічної реакції не можна зробити висновок про її кінетичне рівняння.
Основним законом хімічної кінетики є постулат, що випливає з великої кількості експериментальних даних і виражає залежність швидкості від концентрації. Цей закон, що отримав назву закону діючих мас, формулюється так:
Читайте також:
- Види лекцій
- Викладення лекційного матеріалу
- ГИСТОЛОГИЯ. КОНСПЕКТ ЛЕКЦИЙ.
- Електронний конспект лекцій
- Завдання лекційних занять
- І. ПРОСЛУХОВУВАННЯ ТА КОНСПЕКТУВАННЯ ЛЕКЦІЙ
- ІІ. МАТЕРІАЛИ ДО КУРСУ ЛЕКЦІЙ
- ІІI. Тематика лекцій
- ІІІ. ПЛАН ПРОВЕДЕННЯ ЛЕКЦІЙНОГО ЗАНЯТТЯ
- Індивідуальний метод обліку кількості знесених яєць проводять у селекційних стадах, застосовують для цього контрольні гнізда, або утримання в індивідуальних клітках.
- Коновалова М.Д.Экспериментальная психология: конспект лекций. - Высшее образование. – 2006.
- КОНСПЕКТ
| <== попередня сторінка | | | наступна сторінка ==> |
| Способи визначення порядку реакції | | | Речовин, піднесених до деяких ступенів. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |