
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Класи неорганічних сполук
Неорганічні сполуки поділяють на 4 класи (рис.1.4).
Оксидами називаються складні речовини, які складаються з двох елементів, одним з яких є Оксисен у ступені окиснення -2. Основні оксиди містять атоми металічних елементів, кислотні – неметалічних елементів. Кислотні оксиди, яким відповідають певні кислоти, – ангідриди кислот. При взаємодії кислотних і основних оксидів утворюються солі.
Основи – електроліти, при дисоціації яких в якості катіонів утворюються катіони металів та аніони гідроксиду та взаємодіють з кислотними оксидами і кислотами з утворенням солей.
Деякі основні оксиди та основи (Al2O3, Al(OH)3, ZnO, Zn(OH)2) в залежності від умов можуть взаємодіяти з кислотними оксидами і кислотами. Такі основні оксиди і основи називають амфотерними.
Кислоти – електроліти, при дисоціації яких в якості катіонів утворюються тільки катіони Гідрогену та аніони кислотного залишку, і взаємодіють з основними оксидами і основами з утворенням солей.
Солями називаються електроліти, при дисоціації яких утворюються катіони металів (а також катіони амонію NH4+) і аніони кислотних залишків.
Назви основних неорганічних сполук наведено в таблиці 1.4.
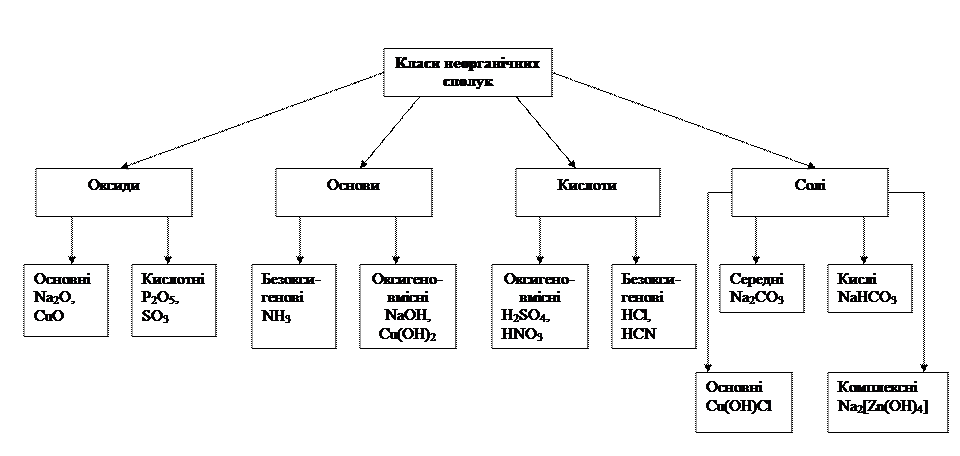
Рис. 1.4. Класифікація неорганічних сполук за складом
Таблиця 1.4 – Назви неорганічних сполук
| Оксиди | Основи | Кислоти | Солі |
| Основні: Na2O – натрій оксид; FeO – ферум (ІІ) оксид. Кислотні: SO3 – сульфур оксид; SO2 – сульфур (ІV) оксид. Амфотерні: ZnO – цинкум оксид; Al2O3 – алюміній оксид; Fe2O3 – ферум (ІІІ) оксид. | Типові основі: NaOH – натрій гідроксид; Fe(OH)2 – ферум (ІІ) гідроксид. Амфотерні гідроксиди: Al(OH)3 – алюміній гідроксид; Cr(OH)3 – хром (ІІІ) гідроксид. | Безоксигенові: HCl – хлоридна4 HBr – бромідна; H2S – сульфідна. Оксигеновмісні: HNO3 – нітратна; HNO2 – нітратна (ІІІ); H2SO4 – сульфатна; H2SO3 – сульфатна (ІV); H2CO3 – карбонатна; H3PO4 – фосфатна. | Clˉ – хлориди; Brˉ – броміди; HSˉ – гідрогенсульфіди; S2ˉ – сульфіди; NO3ˉ – нітрати; NO2ˉ – нітрати(ІІІ) ; HSO4ˉ – гідрогенсульфати; SO42ˉ – сульфати; SO32ˉ – сульфати (ІV); HCO3ˉ – гідрогенкарбонати; CO32ˉ – карбонати; H2PO4ˉ – дигідрогенфосфати; HPO42ˉ – гідрогенфосфати; PO43ˉ – фосфати. |
Оксиди
Хімічні властивості
1. Характерні властивості
1.1. Кислотних оксидів:
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 3CaO = Ca3(PO4)2
1.2. Основних оксидів:
FeO + H2SO4 = FeSO4 + H2O
MgO + SO3 = MgSO4
1.3. Амфотерних оксидів:
ZnO +2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O
2. Варіруючі властивості
2.1. Розклад:
4CrO3 = 2Cr2O3 + 3O2
2.2. Окиснення:
6PbO + O2 = 2Pb3O4
2SO2 + O2 = 2SO3
2.3. Заміщення:
B2O3 + CoSO4 = Co(BO2)2 + SO3 (леткий!)
Умова реакції: утворюється леткий продукт.
2.4. Взаємодія з водою:
BaO + H2O = Ba(OH)2
P2O5 + H2O = 2HPO3 (метафосфатна)
P2O5 + 3H2O = 2H3PO4 (ортофосфатна)
B2O3 + 3H2O = 2H3BO3 (ортоборна)
2NO2 + H2O = HNO3 + HNO2
Умова реакції: реагують ангідриди кислот, оксиди лужних металів, оксиди Са, Ва.
2.5. Взаємодія основних оксидів з кислотними:
СаО + SiO2 = CaSiO3
Одержання:
- взаємодія простих речовин з киснем:
2Mg + O2 = 2MgО
4P + 5O2 = 2P2O5
- взаємодія складних речовин з киснем:
2Н2S + 3O2 = 2SО2 + H2O
- нагрівання солей:
Fe2(SO4)3 = Fe2O3 + 3SO3
2Pb(NO3)2 = 2PbO + 4NO + O2
- розклад оксигеновмісних кислот:
2Н3ВО3 = В2О3 + 3Н2О
- розклад основ при нагріванні
Mg(OH)2 = MgО + Н2О
- розклад вищих оксидів:
4CrО3 = 2Cr2О3 + 3О2
- окиснення нижчих оксидів:
4FeO + O2 = 2Fe2O3
2CO + O2 = 2CO2
- витіснення леткого оксиду:
Na2CO3 + SiO2 = Na2SiO3 + CO2
Основи
Хімічні властивості
1. Характерні властивості:
Ca(OH)2 + CO2 = CaCO3 + H2O
Ni(OH)2 + H2SO4 = NiSO4 + 2H2O
2. Варіруючі властивості:
2.1. Взаємодія з солями:
2КОН + МnCl2 = Mn(OH)2 + 2KCl
CoSO4 + 2NaOH = Co(OH)2 + Nа2SO4
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓
K2SO4 + Ba(OH)2 = BaSO4↓ + 2КОН
Умова: утворення осаду.
2.2. Розклад при нагріванні:
Ba(OH)2 = ВаО + Н2О
Нg(ОН)2 = НgO + Н2О
2АgОН = Аg2О + Н2О
2.3. Взаємодія амфотерних основ з основами:
Аl(ОН)3 + NaOH = Na[Аl(ОН)4]
Zn(ОН)2 + 2KOH = K2[Zn(ОН)4]
Одержання:
- взаємодія лужних та лужноземельних металів та їх оксидів з Н2О:
2Na + 2Н2О = 2NaOH + Н2
Са + 2Н2О = Са(ОН)2 + Н2
СаО + Н2О = Са(ОН)2
- взаємодія солі з лугом:
ZnSO4 + 2NaOH = Zn(ОН)2 + Na2SO4
Cr(NO3)3 + 3KOH = Cr(OH)3 + 3KNO3
Кислоти
Хімічні властивості
1 Характерні властивості
НСl + NaOH = NaСl + Н2О
Н2SO4 + СаО = СаSO4 + Н2О
2. Варіруючі властивості:
2.1. Взаємодія кислоти з сіллю:
NaСl(крист.) + Н2SO4(конц.) = 2НСl(летка) + Na2SO4
Умова: більш сильна кислота витісняє залишок більш слабкої або витісняється летка сполука.
2.2. Розклад оксигеновмісних кислот:
4HNO3 = 4NO2 + 2Н2О + О2
Н2СО3 = Н2О + СО2
2.3 Взаємодія з металами:
НСl, Н3РО4, Н2SO4 (розв.) реагують з металами, що стоять в ряду електродних потенціалів до Гідрогену, з виділенням солі і водню.
Н2SO4 (конц.), 4HNO3 (конц.) реагують з металами з виділенням солі, оксиду, води:
Met + HNO3(конц.) або Н2SO4(конц.) → сіль + оксиди + Н2О
Сu + 4HNO3 = Сu(NO3)2 + 2NO2 + 2Н2О
2.4. Взаємодія з неметалами:
С + 2Н2SO4 = СО2 + 2SO2 + 2Н2О
Одержання:
- взаємодія кислоти з сіллю:
NaNO3 + HPO3 = NaPO3 + HNO3
Умова: більш сильна кислота витісняє залишок більш слабкої або витісняється летка сполука.
- взаємодія кислотних оксидів з водою:
2SO3 + H2O = H2SO4
N2O5 + H2O = 2HNO3
- взаємодія неметалів:
S + H2 = H2S
- взаємодія кислот з неметалами:
3P + 5НNO3 + 2Н2О = 3H3PO4 + 5NO
Солі
Хімічні властивості
1. Взаємодія з основами:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
МgHPO4 + NH4OH = МgNH4PO4 + Н2О
Fe(NO3)3 + 3NaOH = 3NaNO3 + Fe(OH)3↓
Умова: утворення води або осаду.
2. Взаємодія з кислотами:
Ni(OH)NO3 + HNO3 = Ni(NO3)2 + Н2О
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
Na2SO4 + Н2SO4 = NaНSO4 + H2O
Умова: утворення води або газу.
3. Взаємодія з кислотними оксидами:
СаСО3 + SiO2= CaSiO3 + CO2↑
CoSO4 + B2O3 = Co(BO2)2 + SO3↑
Умова: утворення газу.
4. Взаємодія з солями:
BaCl2 + Na2SO4 = BaSO4↓ +2NaCl
Умова: утворення осаду.
5. Взаємодія з металами:
Fe(більш сильний) + CuSO4 = FeSO4 + Cu(слабкий)
6. Взаємодія з неметалами:
Cl2(більш сильний) + 2KI = 2KCl + I2(більш слабкий)
7. Відношення до нагрівання:
2KNO3 = 2KNO2+O2
CaCO3 = CaO + CO2
2Ag2CO3 = 4Ag + 2CO2 + O2
Hg(NO3)2 = Hg + 2NO2 + O2
Одержання:
- взаємодія простих речовин:
2Fe + 3Cl2 = 2FeCl3
Zn + S = ZnS
- нагрівання солей:
2KClO3 = 2KCl + 3O2
4Na2SO3 = Na2S + 3Na2SO4
- взаємодія оксидів:
Ag2O + SO3 = Ag2SO4
- взаємодія солей з більш активними металами:
Сu + Hg(NO3)2 = Cu(NO3)2 + Hg
- взаємодія солей з неметалами:
S + Na2SO3 = Na2S2O3
- взаємодія з солями:
Ag2SO4 + 2KI = 2AgI↓ + K2SO4
Умова: утворення осаду.
- взаємодія з кислотними оксидами:
Cr2(SO4)3 + 3B2O3 = 2Cr(BO2)3 + 3SO3
Умова: утворення газу.
- взаємодія з кислотами:
Fe(OH)2Cl + 2HCl = FeCl3 + 2Н2О
2NaCl(крист.) + Н2SO4 = Na2SO4 + 2HCl↑
СаСО3 + СО2 + Н2О = Са(НСО3)2
Умова: утворення води, газу.
- взаємодія з основами:
ZnCl2 + KOH = KCl + Zn(OH)Cl
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
Читайте також:
- II. Класифікація видатків та кредитування бюджету.
- V. Класифікація і внесення поправок
- V. Класифікація рахунків
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- А .Маршалл - основоположник неокласичної теорії.
- А. Структурно-функціональна класифікація нирок залежно від ступеню злиття окремих нирочок у компактний орган.
- Абстрактні класи
- Адміністративні провадження: поняття, класифікація, стадії
- Азоновмістні органічні сполуки.
- Азосполуки
- Азот, фосфор, біогенні елементи та їх сполуки, органічні речовини
- Аналітичні процедури внутрішнього аудиту та їх класифікація.
| <== попередня сторінка | | | наступна сторінка ==> |
| Окисно-відновні реакції | | | Хімія деяких елементів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |