
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Хімія деяких елементів
Таблиця 1.5– Хімія елементів І та ІІ груп
| Ознаки порівняння | І група головна підгрупа (Li, Na, K, Rb, Cs, Fr) | І група побічна підгрупа (Сu, Ag, Au) | ІІ група головна підгрупа (Be, Mg, Ca, Sr, Ba, Ra) | ІІ група побічна підгрупа (Zn, Cd, Hg) |
| Будова валентного електронного шару | ns1 | (n – 1)d10ns1 | ns2 | (n – 1)d10ns2 |
| Ступінь окиснення | +1 | +1, +2 | +2 | Zn - +2, Hg - +1, +2 |
| Фізичні властивості простих речовин | Лужні метали дуже м’які, білого кольору з сріблястим блиском. | Метали, червоного (мідь), білого (срібло) та жовтого (золото) кольорів з металевим блиском. | Mg і лужноземельні метали (Ca, Ba) – м’які, білого кольору з сріблястим блиском. | Метали білого кольору з сріблястим блиском, ртуть – срібляста рідина. |
| Хімічні властивості простих речовин | Лужні метали дуже активні, сильні відновники. | Малоактивні метали. | Лужноземельні метали – активні, сильні відновники. | Метали середньої активності. |
| Одержання простих речовин | Електроліз розплавів солей. | Добувають з руд (CuFeS2, Ag2S). | Електроліз розплавів солей. | Добувають з руд відновленням та електролізом розчинів |
| Сполуки | Гідриди – MetH. Оксиди – Met2O. Гідроксиди– MetOH – луги: тверді кристалічні речовини, типово йонні сполуки, сильні основи. Солі – типово йонні сполуки, як правило добре розчинні у воді. | Оксиди – MetO, Met2O. Гідроксиди – Cu(OH)2 – основа желеподібна, нестійка на повітрі. Солі – йонні сполуки, розчинність у воді різна. | Оксиди MetO – основного характеру. Гідроксиди– Met(OH)2 – тверді кристалічні речовини, типово йонні сполуки, основи середньої сили. Солі – йонні сполуки, розчинність у воді різна. | Оксид (ZnO) і гідроксид (Zn(OH)2) – амфотерного характеру. Тверді кристалічні речовини, типово йонні сполуки. Солі – йонні сполуки, розчинність у воді різна. |
| Продовження таблиці 1.5 | ||||
| Находження в природі | Найбільш розповсюджені сполуки натрію: NaCl – кухонна сіль; Na2SO4·10H2O – Глауберова сіль; NaNO3 – чілійська селітра. KCl – сильвін; KCl+NaCl – сильвініт. | CuFeS2 – мідний колчедан; Cu2S – мідний блиск. Ag2S – сульфідні руди. Срібло і золото зустрічаються у самородному стані. | Сполуки кальцію найбільш розповсюджені: CaCO3 – крейда, мармур, вапняк; CaCO3·MgCO3 – доломіт; CaSO4·H2O – гіпс. MgCO3 – магнезит. | ZnS – цинкова обманка; ZnCO3 – галлей. HgS – кіновар. |
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів І групи
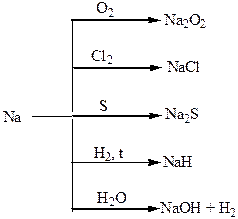
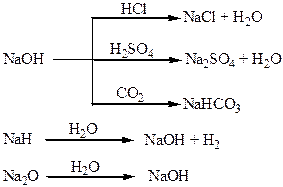
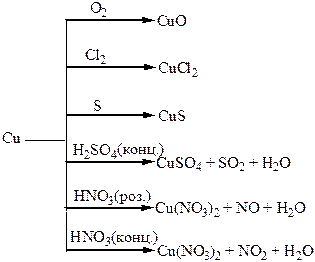
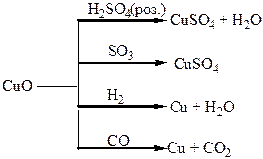
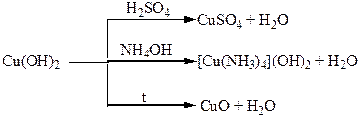
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів ІІ групи
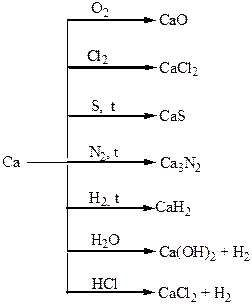
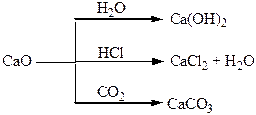
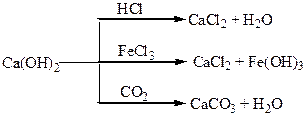
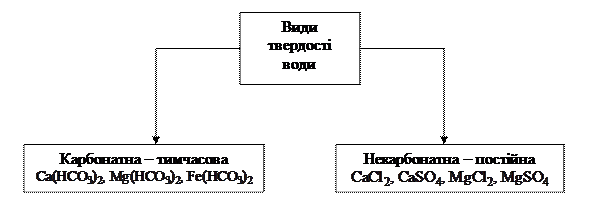
Рис. 1.5. Види твердості води

Рис. 1.6. Методи усунення твердості води
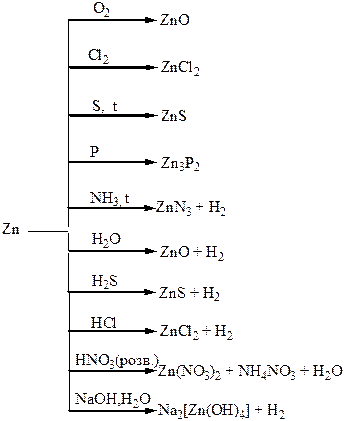
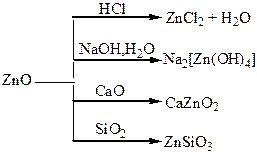
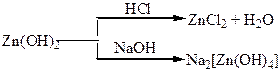
| Таблиця 1.6 – Хімія елементів ІІІ та ІV груп | ||
| Ознаки порівняння | ІІІ група головна підгрупа (B, Al, Ga, In, Tl) | ІV група головна підгрупа (C, Si, Ge, Sn, Pb) |
| Будова валентного електронного шару | ns2np1 | ns2np2 |
| Ступінь окиснення | Al - +3 | +2, +4, (-4) |
| Фізичні властивості простих речовин | Метал алюміній легкий, білого кольору з сріблястим блиском, пластичний. | Карбон – 3 алотропні модифікації (алмаз, графіт, карбін). Аморфний кремній – бурий інертний порошок, алмазоподібна реакційно здатна модифікація – металевий блиск, електропровідність. Олово – сріблясто-білий метал. Свинець – метал голубуватого кольору. |
| Хімічні властивості простих речовин | Метал середньої активності, відновник. | Карбон, силіцій – неметали середньої активності. Свинець досить інертний метал. |
| Одержання простих речовин | Електроліз розплавів солей. | В природі існують поклади графіту. Кремній добувають відновленням оксиду і солей силіцію магнієм чи цинком, олово – відновленням SnO2 коксом, свинець – з сульфідних руд. |
| Сполуки | Оксид (Al2O3) і гідроксид (Al(OH)3) – амфотерного характеру. Тверді кристалічні речовини, типово йонні сполуки. Солі – йонні сполуки, розчинність у воді різна. | Оксиди – неMetO, неMetO2 – кислотного характеру. Гідроксиди – H2SiO3, H2СO3, – слабкі кислоти, нестійкі. MetO, Met(OH)2 – амфотерні: MetO2, Met(OH)4 – основні. |
| Находження в природі | Гірські породи – алюмосилікати. Al2O3·nSiO2 – глини; Al2O3·nH 2O – боксити; Na3AlF6 – кріоліт. | Карбон находіт до складу кам’яного вугілля, нафти. природних газів. CaCO3 – крейда, мармур, вапняк; CaCO3·MgCO3 – доломіт; MgCO3 – магнезит. SiO2 – пісок, кварц; силікати. PbS – свинцевий блиск. |
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів ІІІ групи
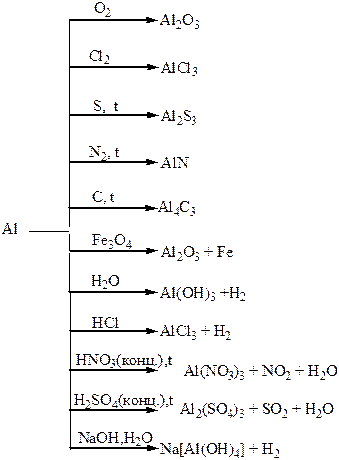
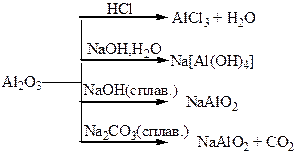
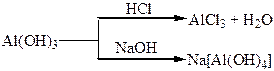
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів ІV групи
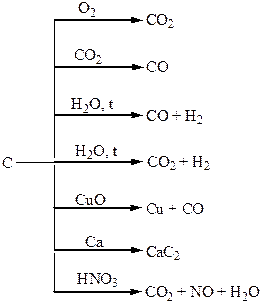
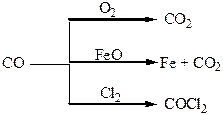
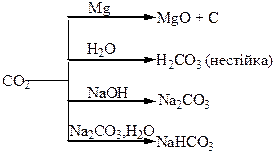
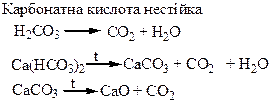
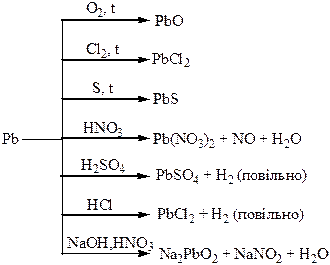

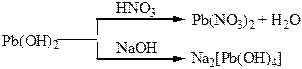
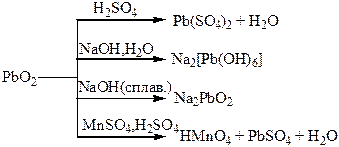
| Таблиця 1.7 – Хімія елементів V та ІV груп | ||
| Ознаки порівняння | V група головна підгрупа (N, P, As, Sb, Bi) | VІ група головна підгрупа (O, S, Se, Te, Po) |
| Будова валентного електронного шару | ns2np3 | ns2np4 |
| Ступінь окиснення | +2, +3, +4, +5. | Оксисен – 2, Сульфур – 2, +4, +6. |
| Фізичні властивості простих речовин | Азот – безбарвний газ без запаху. Алотропні модифікації фосфору – білий, червоний, чорний фосфор. Миш’як – метал. | О2 – безбарвний газ без запаху. Алотропна модифікація оксигену – озон О3 – безбарвний газ з запахом свіжості. Алотропні модифікації сульфуру – сірка ромбічна, пластична, кристалічна. |
| Хімічні властивості простих речовин | Атоми неметалевих елементів можуть віддавати від одного до п’яти електронів в реакціях з простими і складними речовинами. | Кисень і сірка – активні неметали. |
| Одержання простих речовин | Азот одержують ректифікацією повітря. Фосфор одержують електротермічним методом з суміші кальцій фосфату, піску та коксу. | Кисень добувають електролізом води, ректифікацією повітря. Сірку добувають з руд або з самородної сірки. |
| Сполуки | Оксиди Нітрогену і Фосфору – кислотні оксиди. Кислоти: HNO3, HNO2, H3PO4. NH3 – амоніак. Солі: Са3(РО4)2 – “фосфоритна мука”; Са3(РО4)2 + 2Н2SO4 = Са(H2РО4)2 + 2CaSO4 – суперфосфат; Са3(РО4)2 + 4Н3РО4 = 3Са(H2РО4)2 – подвійний суперфосфат; Са(ОН)2 + Н3РО4 = СаНРО4 + 2Н2О – преципітат; 3NH3 + Н3РО4 = NH4H2PO4 + (NH4)2HPO4 – амофос. | H2S – безбарвний газ з неприємним запахом, токсичний, сильний відновник. SO3, SO2 – безбарвні гази з різким запахом, кислотні оксиди, ангідриди відповідних кислот. H2SO4 – сильна кислота, H2SO3 – слабка кислота. |
| Находження в природі | Азот – 78,16% повітря; NаNO3 – чилійська селітра. Са3(РО4)2 – фосфорит; 3Са3(РО4)2·СаF2 – апатит. | Кисень – 23% за масою повітря. Самородна сірка; FeS2 – пірит, залізний колчедан; ZnS – цинкова обманка; Cu2S – мідний блиск. |
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів V групи
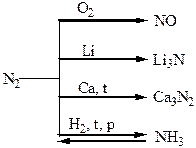
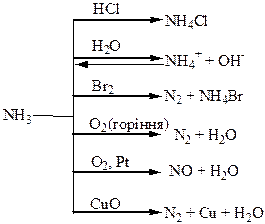
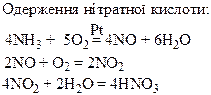
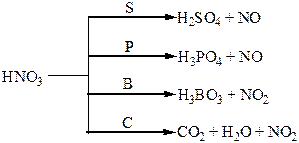
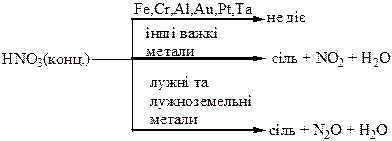
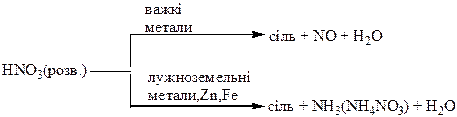
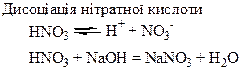
Термічний розклад нітратів металів:
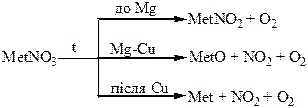
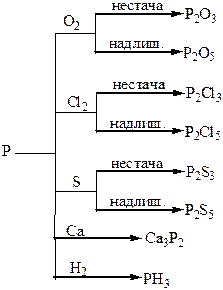
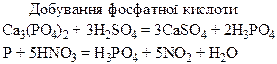
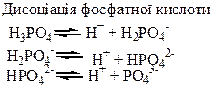
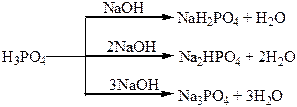
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів VІ групи
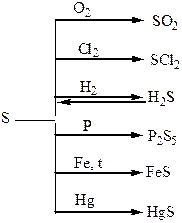
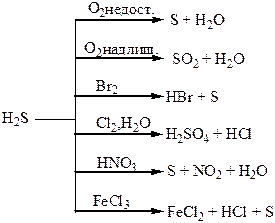
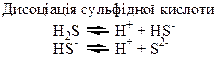
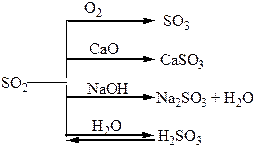
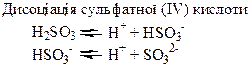
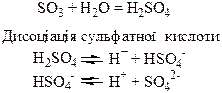
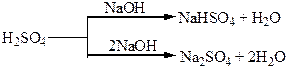
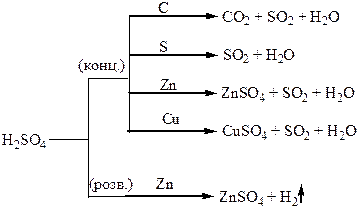
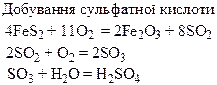
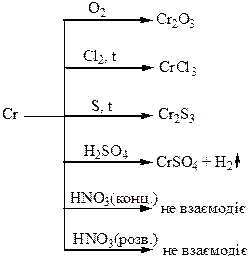
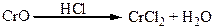
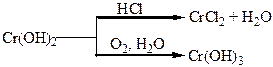
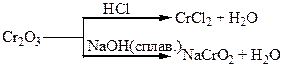
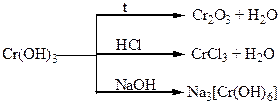
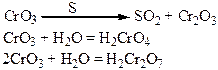
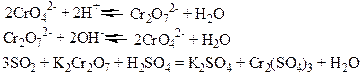
Таблиця 1.8 – Хімія елементів VІІ та VІІІ груп
| Ознаки порівняння | VІІ група головна підгрупа (F, Cl, Br, I, At) | VІІІ група побічна підгрупа (Fe, Ru, Os) |
| Будова валентного електронного шару | ns2np4 | ns2np6(n – 1)d6 |
| Ступінь окиснення | -1, +1, +3, +5,+7. | Fe – +2, +3 |
| Фізичні властивості простих речовин | Сl2 – жовтий токсичний газ, Br2 – коричнева рідина, І2 – чорно-фіолетова кристалічна речовина. Розчинність у воді знижується від хлору до брому. | Залізо – сріблясто білий метал, легко намагнічується, має добру електро- і теплопровідність. |
| Хімічні властивості простих речовин | Найактивніші неметали. | Залізо досить активний метал, тому взаємодіє з більшістю простих і складних речовин. |
| Одержання простих речовин | Хлор одержують електролізом натрій хлориду. Бром і йод одержують з відповідних солей. | Залізо отримують шляхом відновлення воднем його оксидів або хлоридів. |
| Сполуки | Водний розчин НСl – хлоридна кислота, яка має характерні властивості сильних кислот. СаСl(ОСl) – хлорне вапно, дуже сильний окисник. Властивості бромідної кислоти аналогічні властивостям хлоридної, але ця кислота більш сильна (більш сильний відновник). | FeO, Fe2O3 – основні оксиди. Fe(OН)2, Fe(OН)3 – основи. |
| Находження в природі | NaCl – кам’яна сіль; КСl·NaCl – сильвініт. Бром входить до складу цих руд, як домішки. | FeS2 – пірит, залізний колчедан; Fe3O4 – магнітний залізняк; Fe2O3 – червоний залізняк; Fe2O3·3Н2О – бурий залізняк |
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів VІІ групи
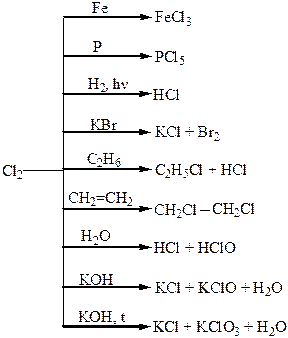
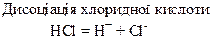
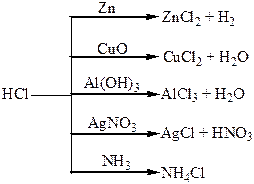
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів VІІІ групи
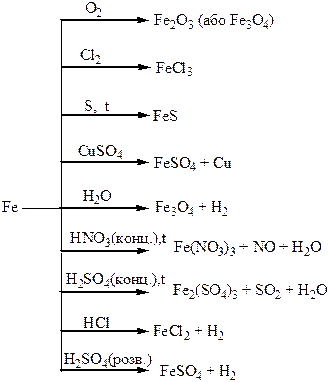

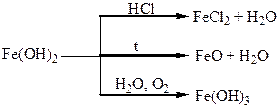
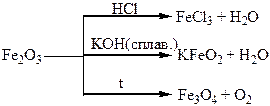
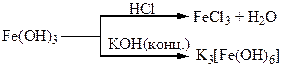
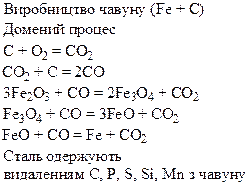
Читайте також:
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- Аверсивную терапію використовують, як правило, при лікуванні алкоголізму, нікотиновій залежності і деяких інших захворювань.
- Аналіз службового призначення деталей та конструктивних елементів обладнання харчових виробництві, визначення технічних вимог і норм точності при їх виготовленні
- Аналітична хімія, як фундаментальна наука.
- Базовий синтаксис деяких основних операторів
- БІОХІМІЯ М’ЯЗІВ І М’ЯЗОВОГО СКОРОЧЕННЯ
- Біохімія наркотиків
- Будова атомів хімічних елементів.
- Будова нагрівальних елементів
- Валентність — це здатність атомів одного елемента сполучатися з певним числом атомів інших елементів під час утворення хімічних сполук.
- Взаємозв’язок елементів управління
- Виберіть 2 положення, які треба добавити у визначення елементів наукової проблеми.
| <== попередня сторінка | | | наступна сторінка ==> |
| Класи неорганічних сполук | | | Література |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |